 HIV 감염인들의 기대수명은 증가세에 있으며 이는 비감염인 수명의 근사치까지 상승했다. 연구에 따르면, 2008년에서 2010년 사이 항레트로바이러스제 치료를 처음 시작한 20세 HIV 감염인의 기대수명은 약 78세로 예측된다.
HIV 감염인들의 기대수명은 증가세에 있으며 이는 비감염인 수명의 근사치까지 상승했다. 연구에 따르면, 2008년에서 2010년 사이 항레트로바이러스제 치료를 처음 시작한 20세 HIV 감염인의 기대수명은 약 78세로 예측된다.아울러 치료제의 발전으로 HIV 감염인의 고령화가 진행되는 동시에, 특히 국내에서는 신규 HIV 감염인의 연령이 20-30대로 낮아지고 있어, 장기적인 다중약물요법의 영향을 최소화하는 것 또한 HIV 치료옵션 선택의 주된 고려사항으로 제시되고 있다.
하지만 평생 치료제를 통해 바이러스를 억제해야 하는 HIV 감염인들은 장기적인 ARV 복용으로 발생할 수 있는 부작용에 대해 불안감을 느끼고 이는 것으로 조사됐다. 2년 이상 HIV/AIDS를 겪은 1,624명의 감염인들을 대상으로 실시한 설문조사에서 ART를 시작할 때와 조사 당시의 우선순위를 비교한 결과 중요도 인식에서 가장 큰 절댓값 증가를 보인 두 가지 우려는 HIV 치료의 장기적 영향을 최소화하는 것과 ART 중 약물의 수를 줄이는 것이었다.
실제로 널리 사용된 다수의 ARV 약물에서 허가 후에도 독성과 부작용에 관한 많은 연구가 이뤄지는 것을 확인할 수 있다. 이는 효과와 안전성이 입증된 약물들도 장기적인 복용에 있어서는 일정의 잠재된 독성과 부작용에 대한 리스크를 갖고 있음을 의미한다.
한국 GSK의 도바토 개발은 이와 같은 장기적 ARV 복용에 불안을 느끼는 HIV 감염인들의 미충족 수요에서 출발했다.
치료 여명을 39.1년으로 가정했을 때 HIV 감염인이 평생 복용해야 하는 약물의 개수는 2제요법 치료 시 총 2만 8543도즈로 줄어든다.
개수를 줄인 ARV를 활용한 항레트로바이러스요법은 치료 미충족 수요를 해소해 감염인의 삶의 질 및 만족도 향상에 기여함은 물론 적은 약물간 상호작용, 치료비용 및 사회적 비용의 감소 등을 기대할 수 있어서 HIV 감염인들의 치료 접근성을 향상시키는 잠재적 가치가 있는 것으로 평가되고 있다.
ARV 약물의 개수를 줄인 도바토가 개발되기까지, 약물의 용량을 줄이거나, PK 부스터 사용을 중단하거나, 혹은 약물의 개수를 줄이는 등의 다양한 임상 전략들이 검토되고 실행됐다. 이 가운데 도바토의 근간이 된 돌루테그라비르와 라미부딘은 2DR 단일정으로서의 효과적인 조합으로 평가된 약물이다.
도바토는 인터그라제 억제제인 돌루테그라비르와 뉴클레오시드역전사효소 억제제인 라미부딘의 2제요법 단일정으로, 대규모 임상을 통해 3제요법과 동등한 성인 HIV-1 감염인의 항바이러스 효과와 안전성 프로파일을 확인했다.
돌루테그라비르와 라미부딘은 약동학적 프로파일이 유사하며, 동시에 서로 다른 작용기전으로 상호 보완적인 치료효과를 기대할 수 있다. DTG는 다섯가지 대규모의 3상 임상을 통해서 높은 내성장벽과 장단기적 내약성을 입증했으며, 3TC는 1998년 이후 모든 치료 가이드라인에 등재된 치료제로서 20년 이상의 효과와 안전성을 확인했다.
◆GEMINI1, GEMINI2 연구 : 144주차에 3제요법 대비 동등한 효과와 낮은 비율의 약물 관련 이상반응 확인
GEMINI 1,2 임상은 1,400명 이상 치료 경험이 없는 성인 HIV-1 감염인이 참여한 글로벌 랜드마크 연구다.
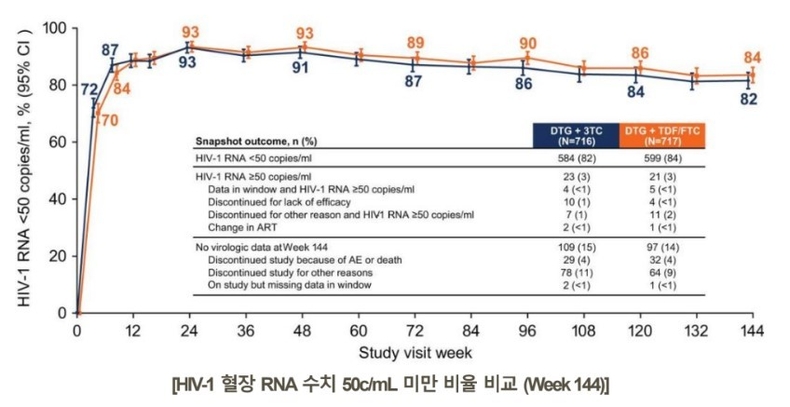
GEMINI 1&2 연구에서 DTG+3TC 2제 복합요법은 HIV-1 바이러스 억제 정도를 측정하는 HIV-1 혈장 RNA 수치 50c/mL 미만 기준에 있어서 DTG+뉴클레오티드/뉴클레오시드 역전사효소 억제제 2제 (테노포비르 디소프록실 푸마르산염/엠트리시타빈 [TDF/FTC]) 병용요법 대비 비열등성을 확인했다.
48주차에서 DTG+3TC 2제요법은 90% 이상의 바이러스 억제율로 DTG+TDF/FTC 3제요법 대비 비열등성을 확인했으며, 144주차에서 DTG+3TC 2제요법은 DTG+TDF/FTC 3제요법 대비 비열등한 효과를 유지했다. (82.0%vs.84% HIV-1 RNA<50c/mL)
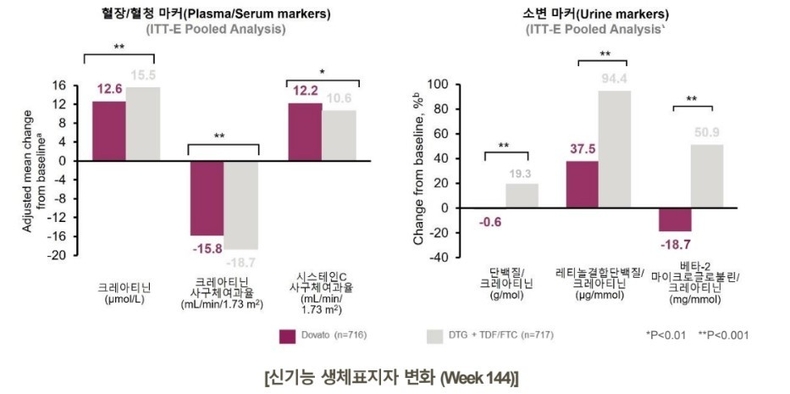
GEMINI 1&2 연구에서 나타난 DTG+3TC 2제요법 안전성 프로파일은 DTG, 3TC 각각의 제품 라벨 정보와 일치했다. 특히 모든 치료군에서 바이러스학적 실패를 경험한 감염인 가운데 인터그라제 억제제, 뉴클레오시드역전사효소 저헤제 및 내성 관련 돌연변이는 발생하지 않았다.
144주차에서 DTG+3TC 2제요법은 DTG+TDF/FTC 3제요법 대비 약물 관련 이상반응이 적은 비율로 나타났으며, 긍정적인 신기능 생표지자 변화와 골전환율 생체표지자 변화가 확인됐다.
◆TANGE 연구 : 144주차 TAF-based regimen 유지군 대비 동등한 효과와 안전성 확인
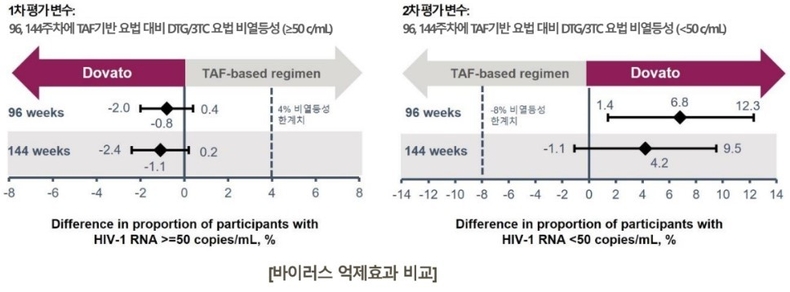
TANGO 연구에서 DTG+3TC 2제 복합요법은 1차 평가변수 및 2차 평가변수 모두에서 TAF 기반 치료군 대비 바이러스 억제 효과에서 비열등성을 입증했다. Drug-related adverse events는 144주차에서 DTG/3TC군(15%)에서 TAF 기반 치료군(5%)에 비해 더 빈번했지만, 48주 이후의 발생률(4%)은 유사했다.
144주차에서 HIV-1 RNA≥50c/mL (virologic non-response)인 감염인은 DTG+3TC 2제요법군에서 0.3%(1명), TAF 기반 치료군에서 1.3%(5명)으로 비열등성을 확인했다. 또 같은 시점에 DTG+3TC 2제요법군에서 내성은 나타나지 않았다.
144주차에서 지질지표는 DTG+3TC 2제요법군에서 TAF 기반 치료군 대비 긍정적인 지질 변화가 나타났다. 144주차에서 DTG+3TC 2제요법군은 신장에 큰 영향을 미치지 않았다.
◆SALSA 연구 : 48주차 다양한 3제 또는 4제요법군 대비 동등한 효과와 안전성 프로파일 확인
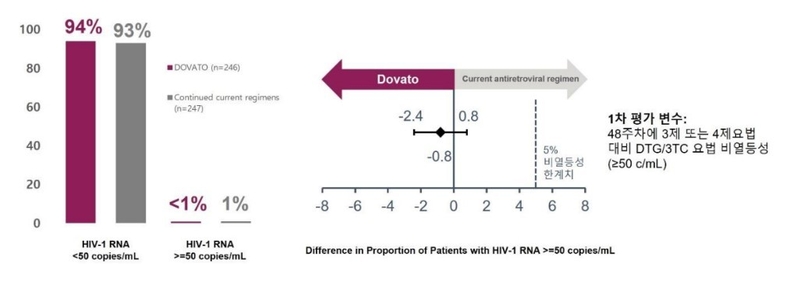
SALSA 연구에서 DTG+3TC 2제 복합요법은 1차 평가변수 및 2차 평가변수 모두에서 3제 또는 4제요법을 포함한 현재요법 유지군 대비 바이러스 억제 효과에서 비열등성을 입증했다.
Drug-related adverse event는 48주차에 DTG+3TC군(20%)에서 CAR(6%)군보다 더 빈번했지만, 24주차 후에는 유사(5% vs2%)했다.
48주차에서 HIV-1 RNA≥50c/mL(virologic non-response)인 감염인은 DTG+3TC 2제요법군에서 0.4%(1명), CAR 치료군에서 1.2%(3명)으로 비열등성을 확인했다.
48주차 DTG+3TC 2제요법군에서 내성은 나타나지 않았다.
48주차에 뼈와 근위세관 신기능은 전반적으로 DTG+3TC 2제요법군에서 유리한 것으로 나타나, 스위칭 시 뼈와 신기능을 유지 또는 개선할 수 있음을 시사했다.
◆STAT : 신속 치료 시에도 투여 24주차까지 치료 유효성과 안전성을 저해하지 않는 것으로 확인
STAT 연구에서 DTG+3TC 2제 복합요법은 HIV 진단 후 14일 이내 HBV 동반감염 여부, 신기능 및 내성 검사 결과가 확인되기 이전에 투여 시 유효성과 안전성 결과에 부정적인 영향을 미치지 않아 항레트로바이러스 신속치료 전략 옵션으로 고려될 수 있음을 입증했다.
24주차에서 HIV-1 RNA data를 확인할 수 없는 참여자를 포함해, 모든 감염인 중 78%(n=102/131)가 50c/mL 미만의 바이러스 수치를 달성했다.
24주차에서 HIV-1 RNA data를 확인할 수 있는 감염인 중에서는 92%(n=102/111)가 50c/mL 미만의 바이러스 수치를 달성했다.
전반적으로 양호한 내약성을 보였으며 grade 2-5 수준의 중증도가 낮은 치료제 관련 이상반응 발생률은 2%(n=2), 중대한 이상반응 발생률 또한 2%(n=2)로 나타났다.
한편 도바토는 미국 보건복지부의 HIV 치료 가이드라인이 initial regimen으로 권고하는 유일한 HIV 2제요법 치료제다.
미국 보건복지부 유럽에이즈학회 가이드라인은 2019년부터 개정안을 통해 도바토를 기존 항레트로 바이러스 치료 경험이 없는 HIV 감염인의 1차 치료요법 및 기존 치료 경험이 는 감염인에서 switching 요법으로 권고했다.
다만 미국보건복지부 가이드라인에서는 HIV RNA>500,000c/mL 감염인, HBV 동시감염이 있는 감염인, 혹은 역전사효소 검출을 위한 HIV 유전자 내성 검사나 HBV 검사 결과가 나오기 이전에 항레트로바이러스요법 치료를 시작하는 감염인은 치료 대상에서 제외한다. 유럽에이즈학회 가이드라인에서는 B형간염바이러스 표면항원(HBsAg)이 양성이거나 HIV 감염 수준(VL)≥500,000c/mL 감염인은 치료 대상에서 제외한다.
노영희 기자 nyh2152@medifonews.com
< 저작권자 © Medifonews , 무단전재 및 재배포금지 >
- 본 기사내용의 모든 저작권은 메디포뉴스에 있습니다.
