희귀의약품 허가 2건…성상세포종 등 치료제 ‘보라니고’
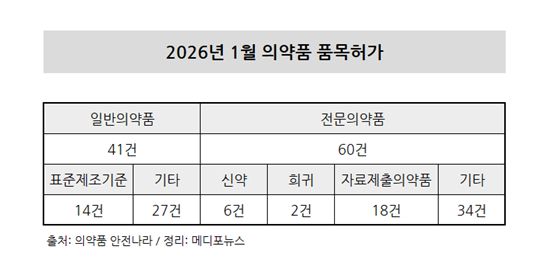
식품의약품안전처 의약품 안전나라에 따르면 2026년 1월 의약품 품목허가는 총 101건 진행됐다. 이 중 전문의약품은 60건으로, 1월 전체 품목허가 건수의 59.4%를 차지했다.
이번 1월 허가된 전문의약품에는 희귀의약품도 2건이 포함됐다. 한국세르비에 보라니고(성분명 보라시데닙)가 그 주인공으로, 10mg와 20mg 용량이 각각 한 건씩 허가를 획득했다.
보라니고는 생검, 대부분 절제 또는 완전 절제를 포함하는 수술 후 40kg 이상의 12세 이상 소아 및 성인의 IDH1 변이 혹은 IDH2 변이가 있는 2등급의 성상세포종 또는 희돌기교종의 치료에 허가됐다.
글로벌 임상3상 연구인 INDIGO에서 보라니고는 중앙 추적관찰기간 14.2개월 시점에 위약 대비 질병진행 또는 사망위험을 61% 감소시켰으며, 무진행 생존기간 중앙값은 27.7개월로 나타나 위약군 11.1개월 대비 유의하게 개선됐다.
보라니고는 다음 치료까지의 개입 시점도 유의하게 지연시켰다. 위약군 대비 후속 치료를 받거나 사망할 위험이 74% 낮았으며, 24개월 시점에서 생존해 있거나 후속 치료를 받지 않은 환자의 비율도 83.4%로, 위약군 27% 대비 뚜렷한 차이를 보였다. 안전성 프로파일 역시 주로 저등급 독성 효과와 관련돼 관리 가능한 수준임이 확인됐다.
보라니고 외에도 다른 전문의약품 허가 현황을 살펴보면, 다이이찌산쿄의 ‘반플리타(성분명 퀴자티닙)’도 17.7mg와 26.5mg에 대한 허가를 획득했다. 반플리타는 FLT3-ITD 변이 양성인 새로 진단받은 급성 골수성 백혈병 성인 환자의 표준 시타라빈 및 안트라사이클린 유도요법과 표준 시타라빈 공고요법과의 병용 및 공고요법 후 단독 유지요법에 사용할 수 있다.
반플리타는 3상연구인 QuANTUM-First 연구를 통해 위약군 대비 사망위험을 22% 감소시킨 것이 입증됐다. 추적관찰 기간 중앙값 39.2개월 시점에서 전체생존기간 중앙값은 31.9개월로 위약군 15.1개월 대비 두 배 이상 연장됐다. 이상반응 발생률도 위약군과 유사한 수준이었으며, 가장 흔하게 발생한 이상반응은 발열성 호중구감소증, 호중구감소증, 저칼륨혈증, 폐렴 등이었다.
갈더마코리아의 ‘넴루비오(성분명 네몰리주맙)’는 ▲중등도에서 중증 아토피 피부염 (성인 및 12세 이상 청소년) ▲결절성 가려움 발진(양진) (성인) 치료제로 허가됐다.
특히 넴루비오는 장기적인 연구에서도 임상적 혜택이 입증됐다. ARCADIA LTE연구 104주차 중간분석 결과, 중등도 및 중증 아토피 피부염 환자를 대상으로 최대 5년간 넴루비오의 장기 안전성과 효능을 평가했을 때, 피부 병변, 가려움, 수면 및 삶의 질에서 지속적이고 의미 있는 개선을 보였다.
OLYMPIA LTE연구 104주차 중간 분석을 통해 최대 4년간 결절성 가려움 발진(양진) 환자에서 넴루비오의 장기 안전성과 유효성을 평가한 결과 넴루비오는 지속적이고 임상적으로 의미 있는 효과를 나타냈다. 또 두 임상연구 모두에서 새로운 이상반응은 확인되지 않았다.
광동제약이 국내에 독점 판매 및 유통하는 이탈리아 제약사 키에시의 ‘람제데(성분명 벨마나제)’도 1월 허가됐다.
알파-만노사이드축적증은 리소좀 내 알파-만노사이드분해효소 결핍으로 인해 만노스가 포함된 올리고당이 분해되지 못하고 축적돼 안면 및 골격 이상, 면역결핍 등이 나타나는 질환이다.
람제데는 유전자재조합 알파-만노사이드분해효소로, 알파-만노사이드축적증 환자에서 부족한 이 효소를 보충해, 장기 내 만노스가 포함된 올리고당의 축적을 감소시키고 비중추신경계 증상을 완화한다.
삼익제약은 P-CAB 계열 위산분비억제제인 ‘브이캡(성분명 보노프라잔)’의 10mg과 20mg를 허가받았다.
일반의약품은 총 41건이 승인됐다. 녹십자의 ‘쿨드림롱’, 동국제약의 ‘멜라텐션크림2%’, 유한양행의 ‘래피코나잘스프레이’, 한올바이오파마의 ‘노바부틴’, 경동제약의 ‘애니코인핫앤쿨플라스타’, 신일제약의 ‘디페온플라스타’, 한국유나이티드제약 ‘알카펜네이잘에이연질캡슐’ 등이 허가됐다.
노영희 기자 nyh2152@medifonews.com
< 저작권자 © Medifonews , 무단전재 및 재배포금지 >
- 본 기사내용의 모든 저작권은 메디포뉴스에 있습니다.
