안진희 (울산의대 서울아산병원 종양내과)

서론
2021년 초 ‘임상의학의를 위한 암 저널 (CA: A Cancer Journal for Clinicians)’에 게재된 논문에 따르면 2020년 한 해 전 세계적으로 약 1,930만 명의 암 환자가 발생했다. 그리고 같은 해 약 230만 건의 유방암 사례가 발생했는데, 그 비중은 전체 암 사례의 11.7%로 20년 동안 1위 자리를 지키던 폐암의 11.4%보다 높았다1). 국내 유방암 환자 수 또한 꾸준히 증가하여, 국내 유방암 증가율은 세계 1위가 되었다. 최근 건강심사평가원의 통계에 따르면 유방암 환자 수는 2000년 한 해 6,237명이었는데, 2015년에는 156,533명으로 증가하였다. 나아가 그 수는 2019년에 222,014명으로 증가하였고 전체 여성 암 발생 중 유방암이 20.3%를 차지하게 되었다. 서구에서는 유방암이 60대 이후의 비교적 높은 연령대에서 많이 발생한다. 그에 반해 우리나라는 40대의 젊은 나이에 유방암이 많이 발생하는 특징이 있으며, 폐경 전 여성 유방암의 비율이 60%에 달하는 것으로 알려졌다.
유방암 환자의 약 10%는 전신 전이가 동반된 4기의 상태에서 발견되며, 조기 유방암으로 적절한 치료를 받은 환자 중 약 30% 정도가 전이성 유방암으로 진행될 수 있다. 따라서 치료 후에도 정기적으로 추적관찰하는 것이 중요하다. 유방암은 주로 뼈, 간, 폐, 림프절, 늑막 등으로 전이되며, 다른 고형암에 비해 비교적 항암요법에 반응이 좋고 생존 기간도 길지만, 여전히 완치는 어렵다. 따라서 전이성 유방암의 가장 중요한 치료 목적은 생존 기간의 연장과 암 관련 증상의 완화를 통한 삶의 질 개선이다. 유방암은 생물학적 특성이 다양하기에 호르몬 수용체(hormone receptor, HR) 및 사람 상피세포 성장인자 수용체 2(human epidermal growth factor receptor-2, HER2) 유무를 반드시 확인하고 이에 근거하여 항호르몬요법, 항암화학요법, 표적 치료제 등을 사용해야 한다. 또한 전이 부위나 증상에 따라서는 수술이나 방사선치료와 같은 국소치료가 도움이 될 수 있으므로, 가능하면 다학제 진료를 통한 최적의 치료를 결정하는 것이 중요하다. 지난 수 년간 전이성 유방암에 대한 새로운 약제가 많이 개발되어 임상에 도입되었고 이는 생존기간의 향상을 가져왔다. 본 원고에서는 유방암의 세 가지 타입, 즉 HR 양성 유방암, HER2 과발현 유방암, 삼중음성 유방암에 대한 약물치료의 최신 경향을 알아보도록 한다.
HR 양성 유방암 (Hormone-Receptor (HR)-positive breast cancer)
HR 양성 유방암은 전체 유방암의 약 60~70% 정도를 차지하는 가장 흔한 유형인데, 다른 타입의 유방암에 비해 비교적 예후가 좋은 편이다. 이 유형은 진단 당시부터 전이가 동반된 경우는 5~10%에 불과하며, 대부분 수술 후 항호르몬 요법(adjuvant antihormonal therapy) 도중이나 치료 종료 후 수 년 또는 10년 이상 경과 후 늦은 재발(late recurrence)로 발현하기도 한다. HR 양성 유방암에 대한 일차적인 치료 방법은 일반적으로 세포독성 항암화학요법이 아니라 여성 호르몬인 estrogen의 작용을 차단하는 각종 항호르몬 요법을 적절하게 사용하는 것이다. 나아가 이를 통해 삶의 질을 유지하면서 생존 기간을 연장시키는 것이다. 그러나 드물게 병의 진행 속도가 매우 빠르고 장기 전이에 의한 증상이 심각한 경우에는 바로 항암화학요법을 시작해야 한다.
항호르몬 요법은 유방암을 촉진시키는 estrogen의 암조직에 대한 영향을 차단하는 것이다. 그 중 가장 잘 알려진 타목시펜 (tamoxifen)은 estrogen 대신 estrogen receptor (ER)에 경쟁적으로 결합하여 estrogen의 작용을 억제하는 약제로서 예전부터 폐경과 무관하게 조기 유방암에 대한 수술 후 보조요법으로 사용되어 왔다. 한편 tamoxifen을 사용하고 있는 도중이나 사용종료 후 수 개월 내에 재발이 생기게 되면 tamoxifen에 대한 내성이 발생한 것으로 판단하여 다른 종류의 약제로 변경하는 것이 필요하다. 폐경 전 환자에게는 지속적인 항호르몬 요법을 위해 우선 난소기능을 억제하여 폐경을 만드는 치료를 선택해야 한다. 그 방법으로는 수술로 양측 난소절제술을 시행하거나 약물치료로 GnRH agonist를 사용하여 폐경을 유도할 수 있다. 일단 폐경 상태가 되면 폐경 후 여성에 대한 항호르몬 요법과 동일한 치료를 시작할 수 있다. 폐경 후 HR 양성 전이성 유방암 환자에게 사용하는 대표적인 약제로는 난소 이외 장기에서 estrogen 이 합성되는 것을 억제하는 아로마타제 억제제 (AI, aromatase inhibitor) 인 letrozole, exemestane, 그리고 선택적 ER 분해제 (SERD, selective estrogen receptor degrader) 인 fulvestrant 등이 있다. 병이 급격하게 악화되거나 일차적으로 사용한 항호르몬제에 전혀 반응하지 않는 경우가 아니라면 지속적으로 다른 기전의 항호르몬제로 변경하는 것이 치료 원칙이다. 또한 가능한 항호르몬 요법을 모두 사용했음에도 병이 진행하는 경우에는 항암화학요법으로 전환하는 것이 필요하다.
지난 몇 년 사이에는 새로운 기전의 치료제인 CDK 4/6 억제제가 개발되었는데, 이는 HR 양성 전이성 유방암 치료의 패러다임을 바꾸는 큰 변화를 가져왔다. CDK4/6 억제제는 세포분열에 중요한 효소인 CDK4 와 CDK6 라는 특정 효소를 억제하여 암세포의 증식을 자극하는 신호를 차단한다. CDK4/6 억제제를 AI 또는 fulvestrant에 병용한 경우를 항호르몬 약제 단독요법과 비교한 대규모의 임상 연구에서 모든 CDK4/6 억제제 병용요법이 무진행생존기간 (progression-free survival) 을 두 배 연장시키는 결과를 보여주었다2~8).
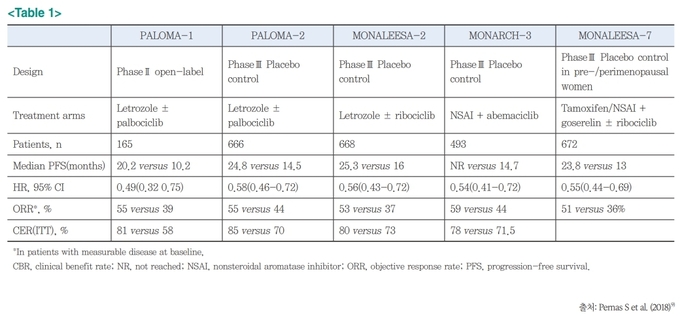
최근에는 장기추적 관찰 연구에서 CDK4/6 억제제를 포함한 항호르몬 요법이 단독 요법에 비해 전체 생존기간을 거의 1년 더 연장시킨다는 결과들이 발표되고 있다. 이러한 고무적인 임상연구 결과를 토대로 현재 국제적인 치료 가이드라인(NCCN guideline)에서도 HR 양성 전이성 유방암에 대하여 AI 또는 fulvestrant과 CDK4/6 억제제를 병행하는 요법이 표준치료로 인정되었다. 또한 국내에서도 palbociclib (Ibrance), abemaciclib (Verzenio), ribociclib (Kisquali) 등 3종류의 CDK4/6 억제제가 NCCN 가이드라인과 동일하게 사용 허가를 받아 임상에서 사용되고 있는 중이다.
한편 PIK3CA 유전자 변이가 있는 HR 양성 유방암은 PIK3 신호전달경로의 과도한 활성화로 인해 항호르몬 요법에 내성이 쉽게 생기고 종양의 성장이 촉진된다는 점이 알려져 있다. PIK3CA 유전자 변이는 HR 양성 전이성 유방암 환자의 약 40%가 보유한 가장 흔한 유전자 변이이다. 이 경우 AI에 내성을 보이는 환자에게 fulvestrant 단독으로 치료하는 요법보다 PIK3CA 특이적 억제제인 alpelisib 을 fulvestrant 에 추가하는 요법이 더 효과적이라는 임상연구가 발표되었다. 그에 따라 이 치료법은 최근 우리 나라에서도 사용 승인을 받은 상태이다10). 이러한 새로운 약제의 등장으로 HR 양성 유방암 환자의 치료 성적은 점차 더 개선되고 있으며, 이제는 조기 유방암 단계의 환자를 대상으로 한 연구도 활발히 진행되고 있다.
HER2 과발현 유방암 (HER2-overexpressing breast cancer)
전체 유방암 환자의 약 20% 정도를 차지하는 HER2 양성 유방암 경우는, 암세포의 성장을 촉진하는 HER2가 암세포의 표면에 과발현하여 재발률이 높고 공격적인 임상 경과를 보인다는 특징이 있다. 유방암의 표적치료제 중 처음으로 trastuzumab(상품명, Herceptin)이 개발되어 1998년 FDA의 승인을 받았다. 이 치료제는 HER2 단백질의 특정 부분에 결합하여 암세포를 공격할 수 있도록 면역체계를 활성화하고 종양세포의 증식에 관련된 신호를 차단하는 역할을 한다. 당시 HER2 양성 전이성 유방암 환자를 대상으로 한 임상 연구에서 기존의 항암제 단독 요법보다 trastuzumab과의 병용요법이 더 효과적인 것으로 나타났는데, 이는 유방암 치료의 큰 전환점이 되었다11). Trastuzumab 이후로도 HER2를 표적으로 하는 많은 신약들이 개발되어 HER2 양성 전이성 유방암이 더 이상 불량한 예후의 대표적 암종이 아니게 되었다. 그 결과 오늘날에는 가장 치료 옵션이 많고 치료 성적이 향상된 암이 되었고, 이에 대해 많은 임상 연구가 진행 중이다.
한편, trastuzumab과는 다른 기전으로 HER2를 억제하는 표적치료제로서 lapatinib (Tykerb), pertuzumab (Perjeta), Trastuzumab emtansine (T-DM1) (Kadcyla) 등이 있다 (Fig.1).
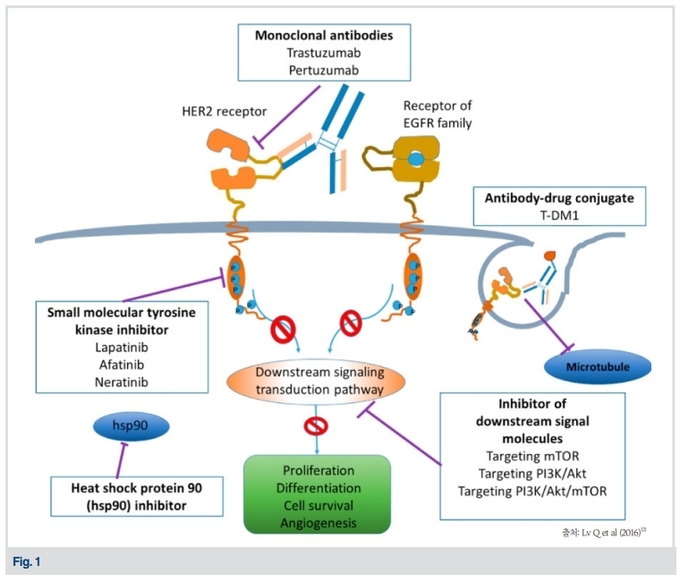
Pertuzumab은 HER2가 다른 HER family 수용체와 결합하는 이합체화(dimerization) 과정을 차단하는 단일클론항체로서 trastuzumab과 상호 보완적 기전을 가지고 있다. HER2를 이중으로 억제하는 것이 더 효과적이라는 점은 CLEOPATRA 임상 연구에서 증명이 되었다. 이 3상 임상연구에서는 HER2 양성 전이성 유방암 환자를 대상으로 기존의 표준요법인 trastuzumab + docetaxel 요법과 두 약제에 pertuzumab 을 추가하는 요법을 비교하였다. 그 결과, 후자의 요법은 역사상 전례 없는 56개월이라는 생존기간 중앙값 (median OS (overall survival))을 보여주었다13). 이를 근거로 trastuzumab, pertuzumab, docetaxel 세 약제의 병용요법이 HER2 양성 전이성 유방암에 대한 첫번째 표준요법이 되었다. 또한 HER2를 이중으로 억제하는 이 방법은 단일 약제보다 더 효과적이라는 점 때문에 HER2 양성 조기유방암의 수술 전 후 보조요법에도 적용되고 있다.
Lapatinib은 TKI (tyrosin kinase inhibitor)로 알려진 경구용 약제로서 세포 내에 있는 HER2 단백질의 tyrosine kinase에 결합하여 세포성장 촉진 신호를 막는 작용을 한다. 이 약제는 trastuzumab, pertuzumab, docetaxel 항암제 치료에 내성이 생긴 환자를 대상으로 capecitabine 경구항암제와 같이 사용된다14). 한편, T-DM1은 trastuzumab 과 emtansine이라는 항암제가 결합된 항체약물결합체(ADC: antibody drug conjugate)이며, 종양세포의 HER2를 찾아내어 적재된 항암제를 방출시키는 기전을 가지고 있다15).
최근에는 새로운 TKI인 tucatinib과 새로운 ADC인 trastuzumab-deruxtacan 등이 개발되어, 이를 이용한 대규모의 임상 연구가 진행 중이다. 이러한 새로운 약제는 HER2 표적치료제에 실패한 경우나 뇌 전이가 있는 경우에도 효과를 보여주어 큰 관심의 대상이 되고 있다16~17).
삼중음성 유방암 (TNBC: Triple-negative breast cancer)
ER, PR, HER2 세 가지 수용체가 모두 없는 삼중음성 유방암 (TNBC) 은 전체 유방암의 약 15~20%에 해당되는데, 이는 다른 유방암 유형에 비해 더 젊은 연령에서 발생하는 경향이 있다. TNBC는 표적이 될 만한 수용체가 없기 때문에 치료의 옵션이 항암화학요법으로 제한적이며 치료 후에도 재발의 위험성이 높고 빠른 진행 속도를 보이는 특징이 있다. 이전부터 사용되어 온 항암제는 주로 anthracycline이나 taxane 계열의 항암제 또는 capecitabine, gemcitabine, vinorelbine, eribulin 등이다. 이 항암제를 단독 또는 병합 요법으로 환자에게 순차적으로 투여하여 생존기간을 연장하는 것이 주된 치료방법이다. 그러나 대부분의 임상연구에서 전이성 TNBC 환자의 median OS는 12~18개월 정도로 매우 불량하였고, 따라서 새로운 약제에 대한 개발과 연구가 매우 필요한 실정이다.
최근 면역항암제는 각종 암에서 매우 효과적인 것으로 나타났고 일부 암에서는 표준요법으로 사용되고 있다. PD-L1 억제제는 암세포에 있는 PD-L1 (programmed death-ligand 1) 단백질에 결합하여 암세포의 면역반응 억제 작용을 막는 기전을 가지고 있다. 그 중 atezolizumab (Tecentriq) 은 전이성 유방암 치료제로 최초로 승인을 받은 약제이다. Impassion130 연구는 이전에 치료받은 적이 없는 전이성 TNBC 환자 902명을 대상으로 한 3상 임상연구로서 atezolizumab + nab-paclitaxel 병용요법과 위약+ nab-paclitaxel 병용요법을 비교하였다. 연구 결과 PD-L1 양성 환자에서 atezolizumab 병용요법군의 median OS가 25개월로 대조군 15.5 개월보다 유의하게 연장되었다18). 이러한 임상연구 결과를 토대로 2020년부터 국내에서도 atezolizumab + nab-paclitaxel 병용요법이 PD-L1 양성인 전이성 TNBC의 첫 치료로 승인되었다. 또한 KEYNOTE-355 임상연구 결과를 근거로 하여 pembrolizumab (Keytruda)과 항암제와의 병용요법도 최근 FDA 승인을 받았다19). 이와 같이 면역항암제와 항암제의 병용요법은 그 동안 효과적인 치료 옵션이 부족했던 전이성 TNBC 치료에 대해 새로운 패러다임을 제시하였다.
PARP 억제제(poly ADP-ribose polymerase Inhibitor)는 BRCA1, BRCA2변이 등과 같이 상동 재조합 복구(HRR, homologous recombination repair)의 결함을 가진 세포의 DNA 손상 반응(DDR, DNA Damage response)을 차단하여 암세포의 사멸을 유도하는 표적 항암제이다. 최근 BRCA 돌연변이가 있는 전이성 TNBC에 대하여 PARP 억제제인 olaparib (Lynparza) 와 Talazoparib (Talzenna) 가 FDA 승인을 받았으며 BRCA 변이를 지표로 한 유방암 환자의 맞춤 정밀의료의 가능성을 높여주었다20~21). 그 밖에 Trop-2 를 표적으로 하는 ADC 인 sacituzumab govitecan도 치료력이 있는 전이성 TNBC 환자에게 효과적인 치료옵션으로 인정받고 다양한 임상 시험에서 연구되고 있다22).
결론
전이성 유방암은 지난 수년간 새로운 약제가 개발되어 활발한 임상 연구가 이루어짐에 따라 생존기간이 꾸준히 향상되고 있다. 특히 이러한 발전에 크게 기여한 약제로는 HR 양성 유방암에 대한 CDK4/6 억제제, HER2 양성 유방암에 대한 새로운 HER2 표적치료제, TNBC에 대한 면역항암제 등이 있다. 그러나 전이성 유방암 치료에서는 효과적인 약제를 사용하더라도 결국 약제 내성이 발생하고 병이 진행되는 것을 막기 어렵다는 한계가 있다. 치료제에 대한 반응을 예측하기 위한 바이오마커 (biomarker)를 개발하고 약제 내성기전을 극복하는 것이 중요한 과제이다. 또한 향후에는 NGS 유전자검사 결과를 기반으로 한 유전자 변이에 맞는 개인 맞춤형 정밀의료가 더욱 중요해질 것이다.
결론적으로 전이성 유방암 치료의 목표는 삶의 질을 최대한 유지하면서 생존기간을 연장하는 것이다. 나아가 유방암의 종류, 전이 부위와 침범 정도, 환자의 연령과 전신 상태 등을 고려하여 환자에게 가장 적합한 치료 방법을 선택할 수 있도록 해야 할 것이다.
Reference
1.Siegel RL et al. Cancer Stastics, 2021. CA: A Cancer Journal for Clinicians. 2021, 71: 7-33
2.Finn RS et al. The CDK4/6 inhibitor Palbociclib in combination with letrozole versus letrozole alone as first-line treatment of estrogen receptor-positive, HER2-negative, advanced breast cancer (PALOMA-1/TRIO-18): a randomized phase 2 study. Lancet 2015, 16 (1): 25-35
3.Finn RS et al. Palbociclib and letrozole in advanced breast cancer. New Engl J Med 2016, 375: 1925-1936
4.Turner NC et al. Overall survival with Palbociclib and fulvestrant in advanced breast cancer. New Engl J Med 2018, 379: 1926-1936
5.Hortobagyi GN et al. Ribociclib as first line therapy for HR-positive, advanced breast cancer. New Engl J Med 2016, 375: 1738-1748
6.Im SA et al. Overall survival with ribociclib plus endocrine therapy in breast cancer. New Engl J Med 2019, 381: 307-316
7.Sledge Jr GW et al. The effect of abemaciclib plus fulvestrant on overall survival in hormone receptor-positive, ERBB2-negative breast cancer that progressed on endocrine therapy – MONARCH2 randomized clinical trial. JAMA Oncology 2020, 6 (1): 116-124
8.Goetz MP et al. MONARCH3: Abemaciclib as initial therapy for advanced breast cancer. J Clin Oncol 2017, 35 (32): 3638-3646
9.Pernas S et al. CDK4/6 inhibition in breast cancer: current practice and future directions. Therapeutic Adv Med Oncol 2018, 10: 1-15
10.Andre F et al. Alpelisib for PIK3CA-mutated, hormone receptor-positive advanced breast cancer. N Engl J Med 2019, 380: 1929-1940
11.Slamon DJ et al. Use of chemotherapy plus a monoclonal antibody against HER2 for metastatic breast cancer that overexpresses HER2. J Clin Oncol 2001, 344 (11): 783-792
12.Lv Q et al. Molecular mechanisms and translational therapies for human epidermal receptor 2 positive breast cancer. Int J Mol Sci 2016, 17, 2095
13.Swain SM et al. Pertuzumab, Trastuzumab, and Docetaxel in HER2-positive metastatic breast cancer. N Engl J Med 2015, 372: 724-734
14.Geyer CE et al. Lapatinib plus capecitabine for HER2-positive advanced breast cancer. N Engl J Med 2006, 355: 2733-2743
15.Verma S et al. Trastuzumab Emtansine for HER2-positive advanced breast cancer. N Engl J Med 2012, 367: 1783-1791
16.Murthy RK et al. Tucatinib, Trastuzumab, and Capecitabine for HER2-positive metastatic breast cancer. N Engl J Med 2020, 382: 597-609
17.Modi S et al. Trastuzumab Deruxtecan in previously treated HER2-positive breast cancer. N Engl J Med 2020, 382: 610-621
18.Schmid P et al. Atezolizumab and nab-paclitaxel in advanced triple-negative breast cancer. N Eng J Med 2018, 379: 2108-2121
19.Cortes J et al. Pembrolizumab plus chemotherapy versus placebo plus chemotherapy for previously untreated locally recurrent inoperable or metastatic triple-negative breast cancer (KEYNOTE-355): a randomized, placebo-controlled, double-blind, phase 3 clinical trial. Lancet 2020, 396: 1817-1828
20.Robson M et al. Olaparib for metastatic breast cancer in patients with a germline BRCA mutation. N Engl J Med 2017, 377 (6): 523-533
21.Litton JK et al. Talazoparib in patients with advanced breast cancer and a germline BRCA mutation. N Engl J Med 2018, 379: 753-763
22.Bardia A et al. Sacituzumab govitecan in metastatic triple-negative breast cancer. N Engl J Med 2021, 384: 1529-1541
출처 :디아트리트 VOL.21, NO.2
안진희 medifonews@medifonews.com
< 저작권자 © Medifonews , 무단전재 및 재배포금지 >
- 본 기사내용의 모든 저작권은 메디포뉴스에 있습니다.
