항암제, 희귀질환 등 연구 활발
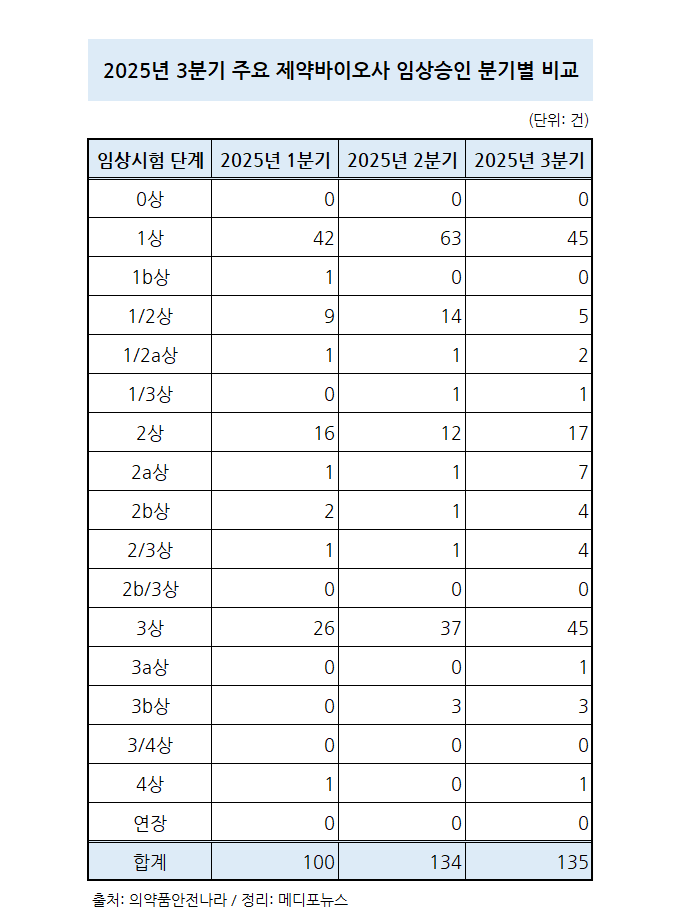
식약처 의약품안전나라 사이트를 통해 3분기 주요 제약바이오사의 임상시험 승인 현황이 확인된 가운데 비교적 3상 이상 단계에서 많은 임상시험 승인이 이뤄진 것으로 나타났다.
3분기 주요 제약바이오사가 승인받은 임상시험은 약 135건으로, 이 중 1상 이상 2상 미만의 단계에서는 53건이 승인됐다.
특히 1상 이상 2상 미만의 단계에서는 아스트라제네카가 4건으로 가장 많은 임상시험이 승인됐다.
AZD5335는 고형암 환자를 대상으로 한 단일요법으로서 및 다른 항암제와의 병용요법으로서 증량을 통해 연구될 예정이다.
AZD4512는 두 건의 임상시험을 승인받았다. 이에 따라 ▲재발성/불응성 B-세포 비-호지킨 림프종(B-NHL) 시험대상자에서 단일요법 또는 다른 항암제와 병용요법 ▲급성 림프 모구성 백혈병 시험대상자에서 단일요법 또는 항암제와 병용요법으로 연구될 예정이다.
STEAP2, CD3, CD8을 표적으로 하는 T 세포 관여 항체 AZD6621는 전이성 전립선암이 있는 성인환자를 대상으로 연구된다.
2상 이상 3상 미만은 총 32건이 승인됐다. 이 단계에서는 노바티스와 애브비가 승인받은 임상시험 건수가 각 4건으로 가장 많았다.
노바티스가 승인받은 임상시험 중 AAA817는 [177Lu]Lu-PSMA 표적 요법 도중이나 이후에 진행된 PSMA 양성 전이성 거세저항성 전립선암 환자를 대상으로, GHZ339는 중등증에서 중증 아토피 피부염이 있는 환자를 대상으로 임상시험이 이뤄질 예정이다.
또한 JSB462는 두 건의 임상시험을 승인받았는데 ▲PSMA 양성 전이성 거세저항성 전립선암이 있는 환자에서 JSB462와 루테튬 비피보타이드 테트라세탄 병용요법 ▲전이성 호르몬 민감성 전립선암이 있는 성인 환자에서 JSB462와 아비라테론 병용요법으로 승인된다.
애브비가 승인받은 임상시험 중 ABBV-400는 ▲국소 진행성 절제 불가능 또는 전이성 EGFR 돌연변이 비편평 비소세포폐암 환자 ▲보조 치료 후 ctDNA 양성 결장직장암이 있고 질병의 방사선학적 증거가 없는(NED) 시험대상자를 대상으로 승인됐다.
또 미르베툭시맙 소라브탄신은 난소암 환자를, ABBV-CLS-628는 상염색체우성 다낭신장병이 있는 환자를 대상으로 임상시험이 승인됐다.
3상 이상에서는 49건이 승인됐는데, MSD와 노바티스가 각각 5건씩 임상시험을 승인받았다.
이 중 MSD의 임상시험 승인 현황을 보면 Belzutifan (MK-6482)는 병기가 진행된 RCC를 앓고 있으며 과거에 항PD-1/L1 보조 요법을 받던 도중이나 그 이후에 질병재발을 경험했던 참가자를 대상으로 한 임상시험을, Sotatercept /MK-7962 (ACE-011)는 폐동맥 고혈압의 치료를 위해 PAH 배경요법에 추가 시의 효과를 평가하기 위한 임상시험을 승인받았다.
MK-1084는 KRAS G12C 돌연변이형의 국소적으로 병기가 진행된 절제 불가 또는 전이성 결장직장암 1차치료, MK-7240는 크론병이나 궤양성 대장염, MK-1022는 호르몬 수용체 양성, HER2 음성 상태의 절제 불가능한 국소 병기 진행성 또는 전이성 유방암을 대상으로 하는 임상시험이 승인됐다.
노영희 기자 nyh2152@medifonews.com
< 저작권자 © Medifonews , 무단전재 및 재배포금지 >
- 본 기사내용의 모든 저작권은 메디포뉴스에 있습니다.
