임상으로 미리보는 상위 제약바이오사 2020년 성적표
3상 제품은 모두 2개 이상이며 허가 중인 제품도 많아
- 강찬구 기자 kcg@medifonews.com
- 등록 2020-04-06 05:50:12
제약사는 미래성장 기반을 확보하기 위한 R&D 역량 강화에 많은 공을 들인다. 연구개발비 확충과 인력 보강 등 다양한 노력을 기울이는데 그런 노력들이 모여 연구개발 실적으로 나타나게 된다. 본지에서는 상위 제약바이오사 5곳의 연구개발 진행 현황을 정리하고 3상 임상 중인 제품 위주로 독자들에게 소개한다.
[편집자 주, 2019년 12월 사업보고서 기준]
[편집자 주, 2019년 12월 사업보고서 기준]
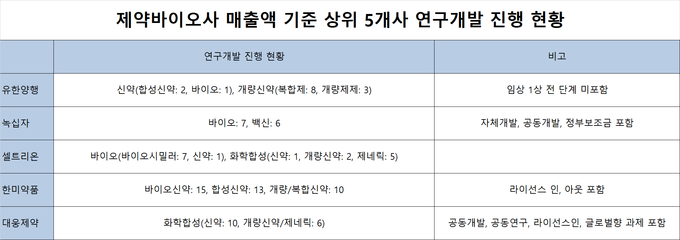
◆유한양행, 3상 4개 및 허가 1개
 유한양행은 현재 임상 3상 단계에 있는 제품(레이저티닙, AD-201, AD-207, AD-203)이 4개이며 1개 제품(AD-101)은 허가 단계에 있다. 3상 단계에 있는 1개 제품(레이저티닙)이 글로벌 단계를 밟고 있는 걸 제외하면 나머지는 한국에서 과정이 진행 중이다.
유한양행은 현재 임상 3상 단계에 있는 제품(레이저티닙, AD-201, AD-207, AD-203)이 4개이며 1개 제품(AD-101)은 허가 단계에 있다. 3상 단계에 있는 1개 제품(레이저티닙)이 글로벌 단계를 밟고 있는 걸 제외하면 나머지는 한국에서 과정이 진행 중이다.제품 별로는 ▲합성신약 ‘레이저티닙(YH25448)’이 EGFR(상피세포성장인자 수용체) 돌연변이 양성 비소세포폐암을 적응증으로 단독요법 글로벌 임상 3상 진행 및 병용요법 글로벌 임상 진행 ▲개량/복합신약 ‘AD-201’이 고지혈·고혈압 순환기용치료제를 적응증으로 발매 예정 ▲개량/복합신약 ‘AD-207’이 고지혈·고혈압 순환기용치료제를 적응증으로 발매 예정 ▲개량신약 ‘AD-101’이 골다공증을 적응증으로 발매 예정 ▲개량신약 ‘AD-203’이 소화기용치료제를 적응증으로 발매 예정 등을 확인할 수 있다.
◆녹십자, 3상 3개 및 허가 심사 2개
 녹십자는 3상 단계에 있는 제품(IVIG SN, GC1102, GC3107A)이 3개이며 2개 제품(그린진에프, MG1111)은 허가 심사가 진행 중이다. 미국에서 3상 단계에 있는 1개 제품(IVIG SN)과 중국에서 허가 심사 중인 1개 제품(그린진에프)을 제외하고는 모두 한국에서 과정이 진행 중이다.
녹십자는 3상 단계에 있는 제품(IVIG SN, GC1102, GC3107A)이 3개이며 2개 제품(그린진에프, MG1111)은 허가 심사가 진행 중이다. 미국에서 3상 단계에 있는 1개 제품(IVIG SN)과 중국에서 허가 심사 중인 1개 제품(그린진에프)을 제외하고는 모두 한국에서 과정이 진행 중이다.제품 별로는 ▲바이오 신약 ‘IVIG SN’이 1차성 면역결핍질환을 적응증으로 2020년 11월 BLA submission(IVIG 10%), 2022년 BLA resubmission(IVIG 5%) 목표 ▲바이오 신약 ‘그린진에프’가 혈우병A 치료제를 적응증으로 2020년 품목 허가 승인 목표 ▲바이오 신약 ‘GC1102’가 HBsAg 양성 간 이식 환자의 B형 간염 재발 예방을 적응증으로 2021년 임상 2b상 CSR 완료 목표 ▲바이오 신약 ‘MG1111’이 수두 감염 예방을 적응증으로 2020년 3월 품목 승인 목표, 2020년 9월 WHO PQ신청 계획 ▲바이오신약 ‘GC3107A’가 결핵예방을 적응증으로 2021년 품목 허가 목표 등을 확인할 수 있다.
◆셀트리온, 3상 2개 및 허가 신청 2개와 심사 4개
 셀트리온은 3상 단계에 있는 제품(CT-P13 SC, CT-P16)이 2개이며 허가 신청인 제품(CT-P17, CT-G07)이 2개, 4개 제품(CT-G03, CT-G04, CT-G06, CT-G12)이 심사 중이다. 한국에서 3상 진행 중인 제품(CT-P16)과 EU에서 허가 신청된 제품(CT-P17)을 제외하고는 모두 미국에서 과정이 진행 중이며 동시에 WHO에 허가 신청(CT-G07)되거나 심사 중인 제품(CT-G06)도 있다.
셀트리온은 3상 단계에 있는 제품(CT-P13 SC, CT-P16)이 2개이며 허가 신청인 제품(CT-P17, CT-G07)이 2개, 4개 제품(CT-G03, CT-G04, CT-G06, CT-G12)이 심사 중이다. 한국에서 3상 진행 중인 제품(CT-P16)과 EU에서 허가 신청된 제품(CT-P17)을 제외하고는 모두 미국에서 과정이 진행 중이며 동시에 WHO에 허가 신청(CT-G07)되거나 심사 중인 제품(CT-G06)도 있다.제품 별로는 ▲바이오시밀러 ‘CT-P13 SC(램시마 피하주사제형)’가 rheumatoid arthritis를 적응증으로 추가 판매 허가 확보 및 기 승인 받은 국가에서 판매 확대 ▲바이오시밀러 ‘CT-P16’이 lung cancer을 적응증으로 임상 종료 후 글로벌 허가 신청 진행 계획 ▲바이오시밀러 ‘CT-P17’이 rheumatoid arthritis을 적응증으로 2021년에 유럽과 미국에 허가 승인 목표 ▲개량신약 ‘CT-G07’이 후천성면역결핍증(HIV/AIDS)을 적응증으로 2020년 4월 FDA 승인 후 국제조달시장 진출 예정 ▲제네릭 ‘CT-G03’이 희귀 간질(LGS)을 적응증으로 2020년 4분기 미국 출시 예정 ▲제네릭 ‘CT-G04’가 신경병증성 통증 치료와 간질을 적응증으로 2020년 3분기 미국 출시 예정 ▲제네릭 ‘CT-G06’이 후천성면역결핍증(HIV/AIDS)을 적응증으로 미국 FDA 허가 승인 예정 ▲제네릭 ‘CT-G12’가 만성 협심증 치료제를 적응증으로 미국 FDA 허가 승인 예정 등을 확인할 수 있다.
◆한미약품, 3상 5개 및 허가 신청 3개
 한미약품은 3상 단계에 있는 제품(LAPS-Exd4 Analog, 오락솔, HIP1601, HCP1701, HCP1903)이 5개 이며 3개 제품(HCP1704, HGP1602, HCP1801)은 허가 신청 중이다. Sanofi사에 라이선스 아웃된 1개 제품(LAPS-Exd4 Analog)과 Athenex사에 라이선스 아웃된 1개 제품(오락솔)을 제외하고는 모두 한국에서 과정이 진행되고 있다.
한미약품은 3상 단계에 있는 제품(LAPS-Exd4 Analog, 오락솔, HIP1601, HCP1701, HCP1903)이 5개 이며 3개 제품(HCP1704, HGP1602, HCP1801)은 허가 신청 중이다. Sanofi사에 라이선스 아웃된 1개 제품(LAPS-Exd4 Analog)과 Athenex사에 라이선스 아웃된 1개 제품(오락솔)을 제외하고는 모두 한국에서 과정이 진행되고 있다.제품 별로는 ▲바이오신약 ‘LAPS-Exd4 Analog(에페글레나타이드)’가 당뇨치료제를 적응증으로 Sanofi사에 라이선스 아웃 ▲합성신약 ‘오락솔(Oraxol)’이 유방암 등 고형암을 적응증으로 Athenex사에 라이선스 아웃 ▲개량/복합신약 ‘HIP1601’이 소화성궤양치료제를 적응증으로 임상1상과 3상을 진행 ▲개량/복합신약 ‘HCP1701’이 순환기용치료제를 적응증으로 임상 3상 진행 중 ▲개량/복합신약 ‘HCP1903’이 고지혈증 치료제를 적응증으로 개발 초기 단계로 예측 불가 ▲개량/복합신약 ‘HCP1704’가 당뇨병치료제를 적응증으로 임상 1상 완료 후 허가 대기 중 ▲개량/복합신약 ‘HGP1602’가 당뇨병치료제를 적응증으로 임상 1상 완료 후 허가 진행 중 ▲개량/복합신약 ‘HCP1801’이 당뇨병치료제를 적응증으로 임상 1상 완료 후 허가 진행 중 등을 확인 가능하다.
◆대웅제약, 3상 2개 및 NDA신청 1개
 대웅제약은 3상 단계에 있는 제품(지방분해, 소화기복합제)이 2개이며 1개 제품(Fexuprazan)은 NDA신청 중이다. 모두 한국에서 진행되고 있다.
대웅제약은 3상 단계에 있는 제품(지방분해, 소화기복합제)이 2개이며 1개 제품(Fexuprazan)은 NDA신청 중이다. 모두 한국에서 진행되고 있다.제품 별로는 ▲신약 ‘Fexuprazan’이 위식도역류질환과 위식도역류질환의 유지요법에 이어 NSAIDs로 인한 궤양 예방 등을 적응증으로 2019년 4Q NDA 신청 예정(2019년 12월 보고서 기준) ▲개량신약/제네릭 ‘지방분해’가 지방분해를 적응증으로 임상 3상 진행 ▲개량신약/제네릭 ‘소화기복합제’가 기능성소화불량을 적응증으로 임상 3상 진행 등을 확인할 수 있다.
- [인사]국경없는의사회, 자비드 압델모네임 신임 국제회장 취임 (9/5)
- [동정]삼성바이오에피스, 직업능력개발 관련 고용노동부 장관 표창
- [인사]보건복지부 과장급 전보 (9/3)
- [동정]대구가톨릭대병원 박기영 교수, 아시아-오세아니아 재활의학회 학술대회서 특별강연·연구발표
- [화촉]남궁승균 JW중외제약 홍보팀 매니저 (9/21)
- [인사]서울성모병원 직원인사(9/1)
- [동정]콜마비앤에이치, ‘한국ESG경영대상’ 중견기업 대상 수상
- [인사]알보젠코리아, 이욱세 신임 대표이사 취임 (9/1)
- [인사]가톨릭대 인천성모병원, 제22대 의무원장에 김종태 교수 선임
- [부음]김강립 前 식품의약품안전처장 모친상
- [동정]삼성바이오에피스, 직업능력개발 관련 고용노동부 장관 표창
- [동정]대구가톨릭대병원 박기영 교수, 아시아-오세아니아 재활의학회 학술대회서 특별강연·연구발표
- [동정]콜마비앤에이치, ‘한국ESG경영대상’ 중견기업 대상 수상
- [동정]원텍, 탈모치료기 ‘헤어빔’으로 2025 올해의 브랜드 대상 7년연속 수상
- [동정]세노비스, 멀티비타민·키즈 비타민 ‘2025 올해의 브랜드 대상’ 수상
- [동정]충남대학교병원 강민웅 교수, 장영실상 수상
- [동정]원텍, ‘올리지오 키스’로 2025 올해의 브랜드 대상 2년연속 수상
- [동정]휴젤, ‘웰라쥬’ 2025 올해의 브랜드 대상 수상
- [동정]고대 구로병원 이의석 교수, 보건복지부장관 표창 수상
- [동정]GC녹십자, ‘2025 노사문화 우수기업’ 선정













