혁신항암신약 '옵디보', '키트루다' 급여 등재에 쏟아지는 관심과 우려
기 사용 환자들, 올해 말까지 다학제구성기관 전원 불가피
- 김윤미 기자 kym@medifonews.com
- 등록 2017-08-28 05:40:00
고가의 혁신항암신약인 항 PD-1 면역항암제 '옵디보'와 키트루다'가 비소세포폐암 환자의 2차 치료제로 건강보헙급여가 적용되며, 기존에 이들 약제를 사용 중이던 환자들과 이들 약제 치료에 적용 가능한 환자군의 관심과 우려가 동시에 쏟아지고 있다.
 이에 건강보헙심사평가원은 지난 8월 21일부로 급여 적용된 '옵디보'와 '키트루다'의 적용범위 기준에 대한 의문점과 급여 인정기관 등에 관한 환자들이 민감하게 반응하고 있는 질문에 대한 답변을 내놓았다.
이에 건강보헙심사평가원은 지난 8월 21일부로 급여 적용된 '옵디보'와 '키트루다'의 적용범위 기준에 대한 의문점과 급여 인정기관 등에 관한 환자들이 민감하게 반응하고 있는 질문에 대한 답변을 내놓았다.
우선 현재 비소세포폐암 환자의 1차 치료제로 적응증이 확대된 MSD의 '키트루다'가 2차 치료제로 급여 적용된 이유에 대해 심평원은 "보험급여 기준은 식약처 허가사항을 기본으로 하고 있으나, 임상적 유용성 및 비용효과성이 인정되는 범위에서 정해지므로 식약처 허가사항보다 제한적으로 설정되는 경우가 있으며, '키트루다'의 경우 제약사가 건강보험 적용 결정을 신청하고 평가를 진행하는 과정에서 허가사항이 확대되어 확대된 내용을 반영하기 위해서는 경제성평가 등 관련 절차를 다시 거쳐야 하므로 환자들에 빠른 건강보험 적용 혜택을 드리기 위하여 결정신청 당시의 허가사항을 바탕으로 급여기준이 결정되었다'고 밝혔다.
따라서 키트루다의 비소세포폐암 1차 치료 확대에 따른 변경된 허가사항에 대한 건강보험 적용 여부 결정을 위해서는 암질환심의위원회 등의 검토가 필요하며, 향후 검토 결과에 따라 보험적용 범위는 변경될 수 있다는 내용이다.
급여 적용 기준의 지표가 되는 PD-L1 검사에 대해서는 '키트루다'는 'IHC 22C3 pharmDx' 동반진단검사로 PD-L1 50% 이상인 경우, '옵디보'는 'IHC 28-8 pharmDx' 검사나 'VENTANA PD-L1(SP263) Assay' 검사로 PD-L1 10% 이상인 경우 급여 적용된다.
심평원은 "최근 'VENTANA PD-L1(SP263) Assay' 검사가 식약처로부터 비소세포폐암에 '옵디보'에 대한 PD-L1 발현을 확인할 수 있도록 추가로 허가되어 이를 급여기준에 반영했다"고 밝히며, "향후 PD-L1 검사에 대한 허가사항 변경 등이 있을 경우 급여기준에 반영될 예정"이라고 답변했다.
급여인정기관과 등재 이전 투여 및 초과 투여에 대한 조치는 환자들이 가장 민감하게 반응한 부분 중 하나였다. 암치료 도중 전원을 하거나 치료 환경이 여의치 않으면 치료 중단으로 이어질 수밖에 없는 부분이기 때문이다.
심평원은 "급여인정기관에서 처방‧투약받는 것이 면역관문억제제의 보험급여 조건 중 하나"라며 "비소세포폐암 급여기준에 해당하는 환자로서 급여인정기관이 아닌 곳에서 투여 중인 환자는 급여인정기관으로 전원하여 처방받은 경우에만 약값 본인 일부부담(5/100)으로 급여가 인정되며, 급여인정기관이 아닌 곳에서 처방받으면 약값전액을 환자 본인이 부담(100/100)해야 한다"고 전했다.
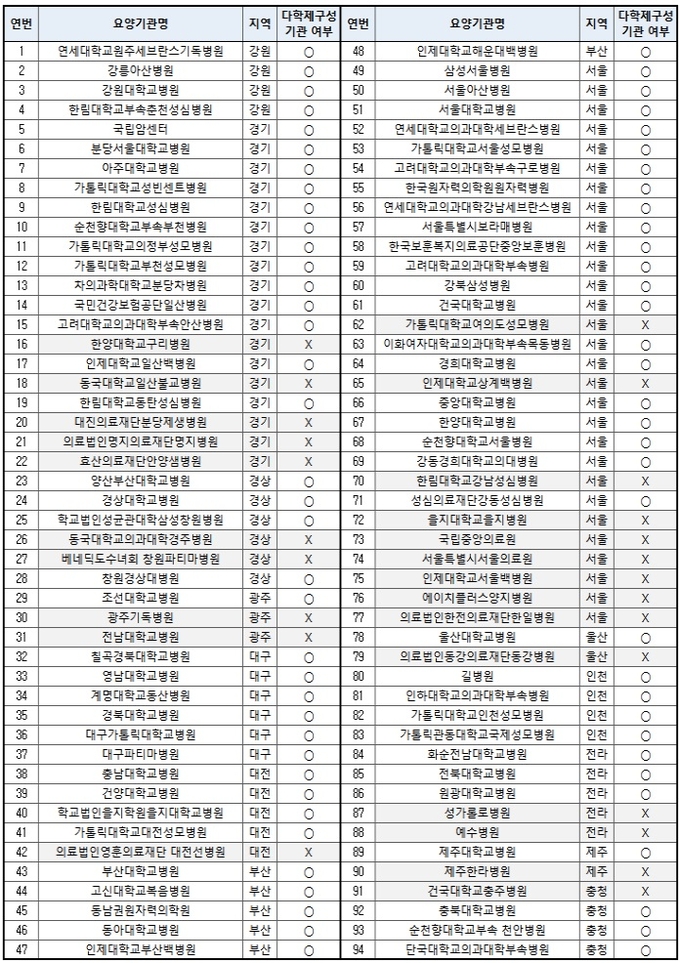
공고 시행일자(2017년 8월 21일) 시점에서 면역관문억제제 급여인정기관 94개이며, 공고 시행일자 시점 이후 해당 기관은 요양기관의 인력 현황 등에 따라 변경될 수 있다.
다만, 94개 급여인정기관 중에서도 다학제구성기관을 갖춘 곳은 70군데로 등재 이전에 '옵디보'와 '키트루다'를 투여 중인 환자와 초과 투여에 대한 급여 적용을 신청해야 하는 환자는 이 70곳으로 전원해야 하므로 환자들은 해당 기관에 대한 정보를 잘 알아두어야 한다.
급여 등재 전 '옵디보'와 '키트루다' 단독 또는 병용요법을 허가범위 초과하여 시행 중인 환자는 진료의가 해당 요법을 지속할 필요가 있다고 판단되는 경우 해당요법이 종료될 때까지 약값 전액을 환자가 부담하여 투여할 수 있다.
다만, 이 경우 다학제적위원회 구성기관으로 전원하여 해당 기관은 2017년 12월 31일까지 환자에 대한 사용 결과 자료를 사전신청 항암요법 자료제출 서식에 따라 제출하여야 한다.
이에 따라 다학제구성기관이 아니거나 급여인정기관이 아닌 곳에서 '옵디보'와 '키트루다' 치료를 받고 있던 환자들은 전원이라는 선택을 필수적으로 해야 하는 상황을 맞은 것이다.
이에 대해 심평원은 "건강보험이 적용되는 항암제를 허가초과로 사용할 때는 의료기관의 다학제적위원회 및 심평원의 '사전승인절차'를 거치는 것이 원칙"이라며, "그러나 등재 이전에 '옵디보, '키트루다'를 허가범위를 초과하여 사용하여 해당 약제에 반응을 보이는 환자의 경우, 등재 이후 해당 절차를 거치는 과정에서 치료가 중단되는 상황이 발생하는 것을 방지해야 하므로 예외를 인정키로 했다고 입장을 밝혔다.
따라서 현재 다학제적위원회 구성기관이 아닌 병‧의원에서 허가초과로 투여 중인 환자는 연말까지 다학제적위원회 구성기관으로 전원해야 하며, 다학제적위원회 구성기관에서 치료가 시작되기 전에는 이전 치료기관인 병‧의원에서 해당 약제를 투여 받을 수 있다. 단, 유예기간은 올해 말까지이며 내년부터는 어떤 경우에도 병‧의원급에서 해당 약제를 허가초과로 사용할 수 없다.
또한 해당 환자 전원 시 이전 치료 기관은 환자의 사용내역 및 결과 자료를 환자가 전원하는 다학제적위원회 구성기관에 전달하여야 한다.
다학제적위원회 구성기관에서는 '옵디보', '키트루다'를 치료 중인 환자에 대하여 등재 이전부터 2017년 12월 31일까지 사용한 결과를 종합하여 제출하여야 하며, 이 경우 제출된 환자에 한하여 '심평원의 허가초과 사용승인'을 받은 것으로 간주된다.
등재 이후 허가초과하여 새롭게 투여하는 환자 또한 다른 항암제의 허가초과 요법과 동일하게 다학제적위원회가 구성된 병원에서 사전신청을 하여 암질환심의위원회의 심의를 거쳐 인정되는 범위 안에서 처방·투여할 수 있기 때문에 신규 환자들 또한 '옵디보'와 '키트루다' 치료를 받기 위해서는 다학제적위원회 구성기관 여부를 주의깊게 확인할 필요가 있다.
- [인사]한림제약 장규열 사장, 단독 대표이사로 선임 (1/19)
- [동정]위아바임 ‘낙산균 프로바이오틱스’, 대한민국 브랜드 명예의 전당 2년 연속 수상
- [동정]한상욱 아주대 의무부총장 겸 의료원장, 한국과학기술한림원 정회원 선출
- [동정]녹십자 ‘비맥스’, 2026 대한민국 브랜드 명예의 전당 5년 연속 수상
- [동정]인하대병원 김장효 교수·조옥민 간호사, 인천시장 표창 수상 ‘응급체계 기여 공로’
- [인사]대전성모병원 이상권 교수, 대한비만학회 부회장 선출
- [동정]서울대병원 김붕년 교수, 문화체육관광부 장관 표창
- [동정]인하대병원 백진휘·신승열 교수, 소방청장 표창 수상
- [인사]고대 안암병원 민재석 교수, 대한위장관외과학회 대한위장관항암연구회 회장 취임
- [인사]대구가톨릭대학교의료원 제11대 의료원장 신홍식 신부 취임
- [인사]한림제약 장규열 사장, 단독 대표이사로 선임 (1/19)
- [인사]대전성모병원 이상권 교수, 대한비만학회 부회장 선출
- [인사]고대 안암병원 민재석 교수, 대한위장관외과학회 대한위장관항암연구회 회장 취임
- [인사]대구가톨릭대학교의료원 제11대 의료원장 신홍식 신부 취임
- [인사]서울약대 강건욱 교수, 한국독성학회/한국환경성돌연변이발암원학회 회장 취임
- [인사]보라매병원 김상완 교수, 대한골대사학회 이사장 취임
- [인사]단국대병원 장성욱 충남권역외상센터장, 외상술기교육연구학회장 취임
- [인사]질병관리청 과장급 전보 (1/19)
- [인사]한림대성심병원, ‘최소침습 내시경 뇌종양 수술 권위자’ 전치만 교수 초빙
- [인사]충남대병원 홍장희 임상시험센터장, 대한임상약리학회 이사장 선출
- [동정]위아바임 ‘낙산균 프로바이오틱스’, 대한민국 브랜드 명예의 전당 2년 연속 수상
- [동정]한상욱 아주대 의무부총장 겸 의료원장, 한국과학기술한림원 정회원 선출
- [동정]녹십자 ‘비맥스’, 2026 대한민국 브랜드 명예의 전당 5년 연속 수상
- [동정]인하대병원 김장효 교수·조옥민 간호사, 인천시장 표창 수상 ‘응급체계 기여 공로’
- [동정]서울대병원 김붕년 교수, 문화체육관광부 장관 표창
- [동정]인하대병원 백진휘·신승열 교수, 소방청장 표창 수상
- [동정]권기범 동국제약 회장, 제약바이오협회 차기 이사장 선임
- [동정]전북대병원 약제부 성창환 약사, 한국병원약사회 학술대회 우수상 수상
- [동정]고대 안암병원 성유나 교수, SABCS 2025 Poster Spotlight 선정 및 LBCA Merit Award 수상
- [동정]의료기관평가인증원, 지속적 가족친화직장문화 조성













