FDA,미충족의료 해결할 신약 3개 BTD·ODD 지정
시신경척수염스펙트럼장애 치료 후보물질 Inebilizumab 등 3개 개발 독려
- 양민후 기자 minhuy@medifonews.com
- 등록 2019-04-23 05:50:00
혁신신약 개발을 위한 제약사의 노력이 시신경척수염스펙트럼장애(NMOSD), 원발담즙간경변증(PBC), 듀시엔 근이영양증(DMD) 등 여러 희귀질환에 대해 이뤄지고
있다. 미국 식품의약국(FDA)은 4월 셋째 주 이들 질환에 효과가 기대되는 후보물질 3개(Inebilizumab∙Elafibranor∙ Pamrevlumab)를 혁신의약품(Breakthrough
therapy) 혹은 희귀의약품(Orphan drug)으로 지정하고 개발과정을 장려하기로
했다.
◇ Inebilizumab, 2상서 시신경척수염스펙트럼장애(NMOSD) attack 감소 효과
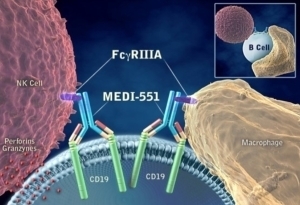 Viela Bio가 개발중인 NMOSD 치료신약 Inebilizumab(MEDI-551)은 인간단일클론항체로 B세포 고갈에
관여한다.
Viela Bio가 개발중인 NMOSD 치료신약 Inebilizumab(MEDI-551)은 인간단일클론항체로 B세포 고갈에
관여한다.
FDA의 혁신신약지정(BTD, 4월18일)은 현재 진행중인 2상 임상시험 ‘N-MOmentum study’(이중맹검∙위약대조∙오픈라벨) 결과를 바탕으로 이뤄졌다.
이 연구에는 NMOSD 환자 231명이 참여했다. 연구진은 참여자의 일부에게 Inebilizumab을 투여하고, 나머지에게 위약을 투여한 뒤 6.5개월간 추적관찰 기간을 가졌다. 이후 참여자 전원에게 6개월간 Inebilizumab을 투여한 뒤 경과를 관찰했다. 연구의 주요 지표로는 NMOSD attack 빈도 등이 측정됐다.
그 결과, inebilizumab 투여군은 위약군 대비 NMOSD attack 발생위험이 77% 감소한 것으로 나타났다. Inebilizumab은 증상악화 예방에도 효과를 보였다. 자세한 결과는 2019 미국신경과학회 연례학술대회(AAN)에서 발표될 예정이다.
Viela Bio 관계자는 “현재 마땅한 치료법이 없는 NMOSD에 새로운 대안을 제공할
수 있도록 노력하겠다”고 전했다.
FDA는 예비적 임상결과에서 기존약보다 우수한 효과를 보인 후보물질을 혁신신약으로 지정하고 있다. 혁신신약으로 지정된 후보물질에게는 우선심사권(Priority review) 등 모든 신속심사권의 자격이 주어진다.
◇ Elafibranor, 원발담즙간경병증(PBC) 주요 마커 감소에 기여
Genfit이 개발중인 Elafibranor은
이중 PPAR알파/델타 작용제로 First-in-class에 속한다. 우루소디옥시콜린산(UDCA)으로 적절한 반응을 얻지 못한 성인 PBC 환자에게 효과가
기대되는 약이다.
FDA는 지난 18일 2상 결과를 참고해 Elafibranor를 혁신신약으로 지정했다. 이 연구(다기관∙무작위배정∙위약대조)에서 Elafibranor은 주요 PBC 마커의 감소에 기여했다.
임상시험에는 UDCA로 효과를 보지 못한 PBC 환자 45명이 참여했다. 치료 12주시점, Elafibranor 투여군은 위약군에 견줘 Alkaline phosphatase 수치가 감소한 것으로 나타났다. 이
밖에도 Gamma-glutamyl transferase, Lipid 마커 수치에서도 유의한 변화가 확인됐다고 제약사측은 설명했다.
Genfit 관계자는 “PBC 환자의 50%는 현존하는 약으로 적절한 반응을 얻지 못하는 것으로 알려졌다”며
“Elafibranor은 이런 환자군을 대상으로 유의한 효과를 보였다”고
평가했다.
Elafibranor은 현재 3상에서
지방간염(NASH)에 대한 효과도 측정되고 있다.
◇ Pamrevlumab, 듀시엔 근이영양증(DMD)에 효과 기대...희귀의약품지정
FDA는 지난 15일 FibroGen이 개발중인 Pamrevlumab을 희귀의약품(Orphan Drug Designation, ODD)으로 지정했다.
Pamrevlumab은 DMD에
효과가 기대되는 약이다. First-in-class로 분류된 인간단일클론항체로, CTGF(결합조직 성장인자)활동을 억제하는 기전을 가지고 있다. CTGF는 섬유증 관련질환의 주요 인자로 알려져 있다.
현재 진행중인 2상(단일군)에는 DMD환자 21명이 참여해 Pamrevlumab을 통한 치료를 52주간 받았다. 연구는 156주까지 진행되며 폐∙심장∙상지근육 기능과 조직섬유화 등이 측정될 예정이다.
FibroGen 관계자는 “FDA의
희귀의약품 지정에 기쁘다”며 “해당질환을 앓는 환자의 미충족의료(unmet need)를 해소할 수 있도록 노력하겠다”고 전했다.
FDA는 유병인구가 20만명
이하인 희귀질환에 효과가 기대되는 약을 희귀의약품으로 지정하고 있다. 희귀의약품 개발사는 연구관련 세금혜택과 유저피(user fees) 면제 등의 대우를 받고, 제품 상용화에 성공하면 7년간 시장독점권을 얻는다.
- [동정]충남대병원 정혜선 대전·충남 권역심뇌혈관질환센터장, 교육부장관 표창
- [동정]가천대 길병원 조자윤 교수, 해양경찰청장 감사장
- [인사]휴메딕스, 신임 연구개발본부장에 최승인 상무 선임
- [동정]보라매병원 김원 교수, 2025년도 ’서울대학술연구교육상(연구부문)’ 수상
- [부음]정수용 루시아치과 원장 부친상
- [동정]인천성모병원, 의료관련감염병 지역 의료기관 네트워크 운영사업 우수상 수상
- [동정]해운대백병원 박병규 교수, 대한정형외과학회 국제학술대회 ‘학술본상’ 수상
- [인사]성균관의대 김태진 교수, 대한면역학회 제44대 회장 취임
- [동정]순천향대 부천병원 이유경 교수, ‘2025 범부처 의료기기 R&D 어워즈’ 공로상 수상
- [인사]건양대학교의료원 인사
- [동정]충남대병원 정혜선 대전·충남 권역심뇌혈관질환센터장, 교육부장관 표창
- [동정]가천대 길병원 조자윤 교수, 해양경찰청장 감사장
- [동정]보라매병원 김원 교수, 2025년도 ’서울대학술연구교육상(연구부문)’ 수상
- [동정]인천성모병원, 의료관련감염병 지역 의료기관 네트워크 운영사업 우수상 수상
- [동정]해운대백병원 박병규 교수, 대한정형외과학회 국제학술대회 ‘학술본상’ 수상
- [동정]순천향대 부천병원 이유경 교수, ‘2025 범부처 의료기기 R&D 어워즈’ 공로상 수상
- [동정]전북대병원 강옥경·유지혜 약사, 한국병원약사대회서 수상
- [동정]강남세브란스병원 최웅락 교수, 한국녹내장학회 ‘연암학술상’ 수상
- [동정]현대약품 황이순 부사장, 환경관리 분야 충청남도지사 표창 수상
- [동정]칠곡경북대병원 최병호 교수, 국민교육발전 유공으로 교육부장관 표창 수상