암, HIV, 당뇨, 코로나19…5월 다양한 약품 특허 등재
암 치료제 최다…C형간염, 천식∙알레르기, 아토피 치료제도 특허
- 노영희 기자 nyh2152@medifonews.com
- 등록 2022-06-08 05:53:28
식품의약품안전처의 의약품 안전나라를 통해 확인한 결과 5월 특허 등재에 성공한 의약품이 총 39개 품목으로 나타났다. 이 중 용량, 제형 등 동일한 제품에 대한 여러 특허들을 제외하면 총 15개 의약품에 대한 특허 등재됐다.
특히 이번 허가에서는 암 치료제, HIV 주사, 당뇨약, 코로나19 백신 등 유의미한 제품들이 다수 포함돼 이번 특허 허가의 의미를 더했다.
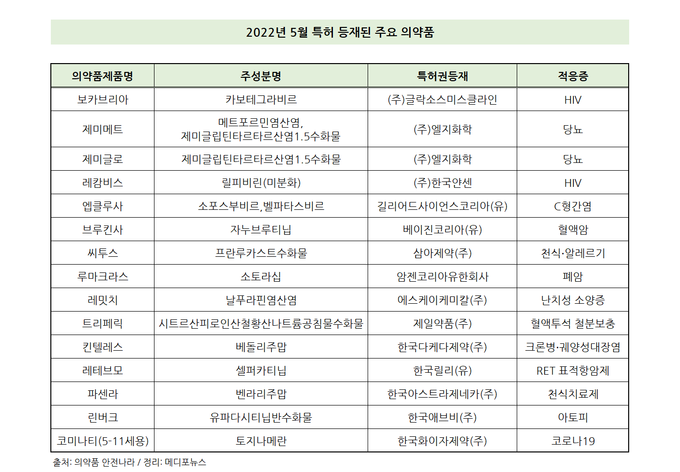
베이진코리아의 혈액암 치료제 ‘브루킨사 80mg(성분명 자누브루티닙)’는 지난 2월 △이전에 한 가지 이상의 치료를 받은 적이 있는 외투세포 림프종(MCL) 성인 환자 단독요법 △발덴스트롬 마크로글로불린혈증(WM) △이전에 한 가지 이상의 치료를 받은 적이 있는 발덴스트롬 마크로글로불린혈증(WM) 성인 환자 단독요법에 대해 허가를 받았다.
이 중에서도 지난 4월에는 암질환심의위원회에서 ‘이전에 한 가지 이상의 치료를 받은 적이 있는 발덴스트롬 마크로글로불린혈증(WM) 성인 환자에서의 단독요법’에 대해 급여 심의를 통과하기도 했다.
브루킨사는 임상 2상만으로도 국내 허가된 만큼, 현재는 1차 치료제로 사용하기 위한 임상 3상 시험이 진행되고 있다.
암젠의 KRAS G12C 변이 국소진행성 또는 전이성 비소세포폐암 치료제 ‘루마크라스정120mg (소토라십)’는 지난 2월에 식약처 허가를 받은 제품이다. KRAS 표적 치료제 최초로 이전에 적어도 한 번의 치료를 받은 적이 있는 KRAS G12C 변이 국소 진행성 또는 전이성 비소세포폐암(NSCLC) 성인환자를 대상으로 허가됐다.
허가의 기반이 된 CodeBreaK100 임상 2상 연구에서는 환자군에서 완전관해와 부분관해를 포함한 객관적 반응률이 36%(n=124, 95% CI: 28-45)로 나타났다. 전체 치료 환자군의 82.3%에서 종양 수축이 관찰됐으며, 반응을 보인 전체 환자의 최대 종양 수축률 중앙값은 60%로 일관되게 높은 치료 효과를 보였다.
또한 해당 임상 연구의 1/2상에 대해 2년 장기 유효성과 안전성 결과를 살펴본 결과 완전관해, 부분관해를 포함한 객관적 반응률은 40.7%, 반응지속기간 중앙값은 12.3개월이었으며 질병조절율은 83.7%였다.
무진행생존기간 중앙값은 6.3개월, 전체생존기간은 12.5개월로 확인됐으며 치료 2년 시점에 전체 연구 참여 환자의 32.5%가 생존해 있는 것으로 나타났다. 장기 추적에서 기존에 없었던 새로운 이상반응에 대한 보고는 없었던 것으로 확인됐다.
릴리의 RET 표적항암제 ‘레테브모캡슐80mg(성분명 셀퍼카티닙)’은 3월 ▲전이성 RET 융합-양성 비소세포폐암 성인 환자 ▲전신요법을 요하는 진행성 또는 전이성 RET-변이 갑상선 수질암이 있는 성인 및 만 12세 이상 소아 환자를 대상으로 허가됐다.
또 ▲방사선 요오드에 불응하고, 이전 소라페닙 및/또는 렌바티닙의 치료 경험이 있으며 전신요법을 요하는 진행성 또는 전이성 RET 융합-양성 갑상선암 성인 환자를 위한 치료제로도 승인됐다.
허가는 RET 변이가 있는 진행성 혹은 전이성 고형암 환자 702명을 대상으로 진행된 LIBRETTO-001 임상 연구를 기반으로 이뤄졌다.
백금 기반 항암화학요법 치료 경험이 없는 RET 융합-양성 비소세포폐암 환자군에서 객관적 반응률은 85%(95% CI, 70-94)였다. 추적 기간(중앙값 7.4개월) 동안 79%에서 지속적인 반응을 보여 반응지속기간은 중앙값에 도달하지 않았다.
백금 기반 항암화학요법 치료 경험이 있는 환자군에서는 객관적 반응률은 64%(95% CI, 54-73), 반응지속기간 중앙값은 17.5개월(95% CI, 12.0-NE)로 확인됐다.
비소세포폐암 2차 평가변수로 중추신경계 전이 환자의 객관적 반응률을 별도로 평가한 결과 백금 기반 항암화학요법 치료 경험이 있고 뇌전이 부위의 측정이 가능한 RET 융합-양성 비소세포폐암 환자 11명 중 10명에서 중추신경계 객관적 반응이 확인됐다.
이전에 반데타닙 및/또는 카보잔티닙 치료 경험이 없는 RET-변이 갑상선 수질암 환자군에서 레테브모의 객관적 반응률은 73%(95% CI, 62-82), 완전 반응 비율은 11%였으며, 반응지속기간의 중앙값은 22.0개월(95% CI, NE-NE)이었다.
반데타닙 및/또는 카보잔티닙 치료 경험이 있는 환자군에서는 객관적 반응률은 69%(95% CI, 55-81)였고, 추적 기간 동안 84%의 환자가 지속적인 반응을 보여 반응지속기간은 중앙값에 도달하지 않았다.
소라페닙 및/또는 렌바티닙 치료 경험이 있는 RET 융합-양성 갑상선암 환자군에서 레테브모의 객관적 반응률은 79%(95% CI, 54-94), 반응지속기간의 중앙값은 18.4개월(95% CI, 7.6-NE)이었다. 주요 2차 평가변수 중 하나인 무진행생존기간 중앙값은 20.1개월(95% CI, 9.4-NE)로 확인됐다.
요즘 같은 때에 큰 역할을 해내고 있는 화이자의 코로나19 mRNA 백신 ‘코미나티주0.1mg/mL (토지나메란)’은 5-11세용에 대한 특허를 등재했다.
코미나티주0.1㎎/㎖(5-11세용)는 5~11세의 코로나19 예방 목적으로 美 화이자가 개발∙생산한 mRNA 백신이다. 기존에 허가된 ‘코미나티주’, ‘코미나티주0.1㎎/㎖’과 유효성분(토지나메란)은 같지만 1회 접종 시 투여량은 1/3(10㎍)에 그친다.
식약처는 코미나티주0.1㎎/㎖(5-11세용) 29만9000회분에 대해 검정시험을 수행하고 제조사의 제조∙시험 자료를 검토한 결과 효과성, 안전성, 품질을 확인했으며, 기준에 적합해 3월 국가출하 승인을 결정했다.
LG화학는 복제약 출시를 앞두고 있는 시점에서 자사 당뇨약 ‘제미메트서방정50/1000밀리그램(성분명 메트포르민염산염, 제미글립틴타르타르산염1.5수화물)’과 제미글로정50밀리그램(성분명 제미글립틴타르타르산염1.5수화물)에 대해 특허 등재에 성공했다.
HIV 치료제에서는 GSK(글락소스미스클라인)가 ‘보카브리아주(성분명 카보테그라비르)’를, 얀센이 ‘레캄비스주사(성분명 릴피비린)’를 특허 등재시켰다.
이외에도 C형간염, 천식∙알레르기, 난치성 소양증, 크론병∙궤양성대장염, 아토피 등 다양한 적응증을 토대로 한 의약품들이 5월 동안 허가됐다.
- [부음]김권식 메디포뉴스 전무 빙모상
- [동정]인천성모병원 이순규 교수, 대한간암학회 학술대회 우수구연상 수상
- [동정]명지병원 김민석 교수, 제62차 세계흉부외과학회 ‘Maxwell Chamberlain 논문상’
- [동정]고대 구로병원 병리과, 서울특별시장 표창·서울시의회 의장상 동시 수상
- [부음]이학철 前 부산시한의사회 회장·이학종 분당서울대병원 의생명연구원장 부친상
- [동정]한림대성심병원 하상욱 권역응급의료센터장, 소방청장 표창 수상
- [동정]경북대병원 손상균 교수, 대한민국의학한림원 정회원 선출
- [인사]서울성모병원 장기육 교수, 대한심혈관중재학회 차기 회장 추대
- [동정]서울대병원 이창현 교수팀, 대한척추변형연구회 ‘서봉 최우수 학술상’ 수상
- [인사]영남대 영천병원, 제18대 박삼국 병원장 취임
- [인사]서울성모병원 장기육 교수, 대한심혈관중재학회 차기 회장 추대
- [인사]영남대 영천병원, 제18대 박삼국 병원장 취임
- [인사]명지병원, ‘뇌졸중 전문가’ 최영빈 교수 영입
- [인사]동산의료원·동산병원·대구동산병원 보직인사(2/1)
- [인사]삼성서울병원, 원장단 및 주요 보직 인사(2/1)
- [인사]배재훈 교수, 계명대학교 동산의료원장 취임
- [인사]동화약품, 장재원 연구개발본부장 선임
- [인사]HLB 자회사 엘레바, 김동건 대표 선임
- [인사]서울대병원 우홍균 교수, 아시아방사선종양학회연합회 회장 취임
- [인사]서울대병원 박중신 교수, 제26대 대한의학회 회장 선출
- [동정]인천성모병원 이순규 교수, 대한간암학회 학술대회 우수구연상 수상
- [동정]명지병원 김민석 교수, 제62차 세계흉부외과학회 ‘Maxwell Chamberlain 논문상’
- [동정]고대 구로병원 병리과, 서울특별시장 표창·서울시의회 의장상 동시 수상
- [동정]한림대성심병원 하상욱 권역응급의료센터장, 소방청장 표창 수상
- [동정]경북대병원 손상균 교수, 대한민국의학한림원 정회원 선출
- [동정]서울대병원 이창현 교수팀, 대한척추변형연구회 ‘서봉 최우수 학술상’ 수상
- [동정]대전을지대병원 홍민정 간호국 파트장, 소방청장 표창 수상
- [동정]고려대의료원 윤주성 팀장, 대한병원정보협회장 연임
- [동정]일산백병원 최준영 교수, ‘상병수당 제도 발전 기여’ 국민건강보험공단 이사장 표창
- [동정]아주대학교병원 교수 7명, 대한민국의학한림원 정회원 및 공헌회원 선출












