ASH 2019 개막, 재발·불응성 혈액암 다양한 대안 제시
'레블리미드∙가싸이바' 콤보 NHL서 높은 반응률..리툭산 경험군에 ORR100%
임상단계신약 'LOXO-305', B세포 백혈병 및 림프종서 가능성
- 양민후 기자 minhuy@medifonews.com
- 등록 2019-12-10 05:50:00
미국 혈액학회 연례학술대회(ASH 2019)가 지난 7일(~10일, 현지시간) 미국 올랜도에서 개막했다. 행사에선 재발 및 불응성 혈액암에 대안을 제시하는 연구결과가 발표되고 있다.
먼저 세엘진은 레블리미드(성분명:레날리도마이드, 제약사:세엘진)와 가싸이바(오비누투주맙, 로슈) 조합의
비호지킨림프종(NHL) 치료효과를 안내했다. 콤보는 2차 이상 치료에 사용돼 높은 객관적반응률(ORR)을 기록했다. 릴리는 신약의 가능성을 소개했다. LOXO-305는 많은 치료를 경험한 B세포 백혈병 및 림프종 환자군에서 반응률 관련 잠재성을 보였다.
◇ 레블리미드∙가싸이바, NHL서 효과..리툭산 불응그룹에 ORR 100%
세엘진은 레블리미드∙가싸이바 콤보의 임상시험(1/2상·단일군) 결과를 발표했다. 연구에는 재발성 지연형 NHL 환자 66명(평균 64세)이 참여했다. 소포성 림프종(FL)이 57명이었고, 소림프구성림프종(SLL) 5명, 변연부림프종(MZL) 4명 등도 포함됐다. 이들은 앞서 평균 2차 이상의 치료를 경험한 것으로 나타났다.
연구진은 참여자들에게 레블리미드∙가싸이바 콤보를 투여하며 경과를 관찰했다. 레블리미드는 총 3가지 용량(10∙15∙20mg)이
활용됐다. 주요지표로는 ORR과 최대내약용량(MTD)이 평가됐다. 2차평가변수로는 무진행생존기간(PFS), 전체생존기간(OS), 부분반응(PR) 등이 측정됐다.
그 결과, ORR은 98%였다. 이 중 완전반응(CR)은 72%로
조사됐다. 하위그룹분석에선 환자의 배경과 무관하게 일관된 ORR이
확인됐다. 먼저 ORR은 리툭산(리툭시맙, 로슈) 불응
그룹에서 100%(CR:63%)를 기록했다. 앞서 3차 이상 치료를 경험한 그룹에선 97%(68%), 2년내
진행을 경험한 그룹에선 96%(66%)로 나타났다.
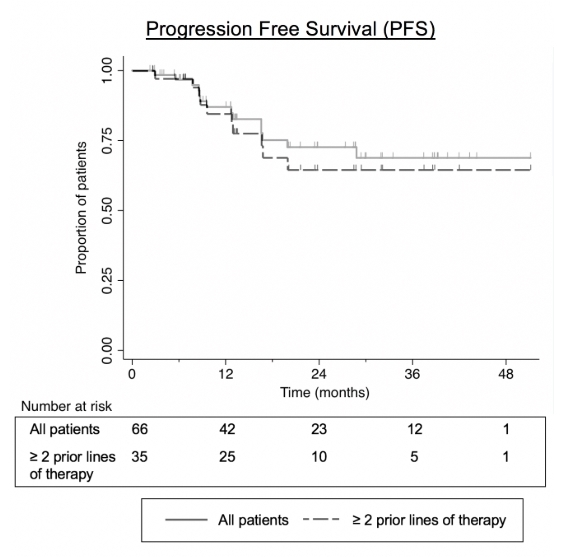
평균 17.7개월 추적관찰결과, 2년
PFS 비율은 73%였다.
이런 비율은 하위그룹분석에서 다소 차이를 보였다. 세부적으로 FL군에서 74%, MZL/SLL군에서 65%로 집계됐다. 앞서 2차
이상 치료를 받은 환자군에선 64%로 분석됐다.
2년 OS 비율은 94%였다.
연구에서 3등급 이상 독성 관련 이상사례는 피로, 발진, 기침 등이 보고됐다. 3등급이상
백혈구감소증, 혈소판감소증 발생률은 각각 17%, 11%로 확인됐다. 독성 프로파일은 레블리미드∙리툭산 콤보와 유사한 수준으로 평가됐다.
연구결과를 발표한 MD앤더슨 암센터 Nathan H Fowler 교수는 “레블리미드∙가싸이바 콤보는 다양한 하위그룹에서 우수한 반응을 보였다”며 “특히 리툭산 불응그룹, 2년내 진행경험군 그리고 3차 치료군에서 높은 반응률을 이끌어냈다”고 평가했다.
◇ 임상단계신약 LOXO-305, B세포 백혈병 및 림프종서 가능성
릴리는 BRUIN(1/2상∙단일군∙다기관∙다국가) 결과를 공유했다. 연구에는 B세포 백혈병 및 림프종 환자 28명(평균 66세)이 참여했다. 만성림프구성백혈병(CLL) 16명, 외투세포림프종(MCL) 8명, 발덴스트롬 거대글로불린혈증(WM) 2명, 거대 B-세포 림프종(DLBCL) 1명, 그리고 MZL 1명이 모집됐다.
참여자들은 평균
4차 이상의 치료를 경험했다. 이들 중 10명(CLL 7명/MCL 3명)은 임브루비카(이브루티닙, 얀센) 등 BTK 억제제(Bruton's.
Tyrosine Kinase Inhibitor)에 불응한 경험이 있다. 연구진은 참여자들에게 LOXO-305(25~200mg)를 투여하며 경과를 지켜봤다. 1차평가변수는 MTD, 2차평가변수는 ORR 등이었다.
연구결과, CLL 그룹에서 평가 가능한 환자는 13명이었다. 이 중 10명(77%)은 ORR을 보였다. 반응은 C481S 변이(BTK억제제 내성기전) 보유여부와 무관하게 나타났다. BCL G101V 변이(BCL2 억제제 내성기전) 양성여부와도 관계없었다.
MCL 그룹에선 평가할 수 있는 환자가 총 6명이었다. 이 가운데 3명(50%)은
ORR을 기록했다. 이외 종양에 대해 LOXO-305는 최소 반응(MR) 또는 안정병변(SD)을 기록했다.
평가 시점, 전체참여자 중 86%는 치료를 지속하고 있었다. LOXO-305의 안전성은 대체로 양호한 것으로 평가됐다.
이런 결과를 안내한 미국 메모리얼 슬로안 캐터링 암센터 Anthony R. Mato 박사는
“LOXO-305의 다양한 용량은 연구에서 CLL 및 MCL에 대해 효과를 보였다”며 “안전성 측면에서 off-target 관련 증상은 발견되지 않았다”고 설명했다.
LOXO-305는 비공유성 결합
BTK 억제 후보물질이다. 와일드타입 또는 C481변이 BTK를 저해하는 기전을 가지고 있다. 제약사측은 BRUIN 등록환자를 190명까지 확대할 예정이다.
- [동정]칠곡경북대학교병원 하윤석 교수, 대한비뇨의학회 ‘국내논문 기초 최우수상’ 수상
- [인사]강동경희대학교병원 심계식 교수, 대한소아내분비학회 회장 취임
- [인사]고대 구로병원 이재관 교수, 대한산부인과학회 신임 이사장 선출
- [인사]일동생활건강 신임 대표에 박하영 상무 선임 (11/1)
- [동정]노원을지대학교병원 최남홍 교수, 대한정형외과학회 국제학술대회 ‘만례재단 학술상’ 수상
- [동정]충남대학교병원 전소영 교수, 대한응급의학회 우수 구연발표상 수상
- [동정]경북대병원 박성현 교수·김병목 방사선사, 대한신경외과학회 정상섭 학술상 수상
- [인사]웰스바이오, 서석찬 신임 대표이사 선임
- [동정]단국대병원 이용진 교수, 대한의료인공지능학회 학술상 수상
- [동정]보라매병원 조현철 교수, 복지부 장관 표창 수상
- [인사]강동경희대학교병원 심계식 교수, 대한소아내분비학회 회장 취임
- [인사]고대 구로병원 이재관 교수, 대한산부인과학회 신임 이사장 선출
- [인사]일동생활건강 신임 대표에 박하영 상무 선임 (11/1)
- [인사]웰스바이오, 서석찬 신임 대표이사 선임
- [인사]대한전공의협의회 한성존 회장 당선
- [인사]동아쏘시오그룹 임원 인사 (11/1)
- [인사]전남대병원 이지범 교수, 대한피부과학회 제63대 차기 회장 공식 인준
- [인사]한림대성심병원 장대영 교수, 대한위암학회 신임 회장 취임
- [인사]서울약대 이정원 교수, 분자·세포생물학회 2027년 회장 당선
- [인사]고려의대 윤석준 교수, 제18대 대한예방의학회 이사장 선출
- [동정]칠곡경북대학교병원 하윤석 교수, 대한비뇨의학회 ‘국내논문 기초 최우수상’ 수상
- [동정]노원을지대학교병원 최남홍 교수, 대한정형외과학회 국제학술대회 ‘만례재단 학술상’ 수상
- [동정]충남대학교병원 전소영 교수, 대한응급의학회 우수 구연발표상 수상
- [동정]경북대병원 박성현 교수·김병목 방사선사, 대한신경외과학회 정상섭 학술상 수상
- [동정]단국대병원 이용진 교수, 대한의료인공지능학회 학술상 수상
- [동정]보라매병원 조현철 교수, 복지부 장관 표창 수상
- [동정]전북치대 윤정호 교수, 첨단재생의료 진흥 공로로 보건복지부 장관상 수상
- [동정]중앙대병원 이호석 교수, 대한재활의학회 ‘우수연제상’ 수상
- [동정]박희덕 팜젠사이언스 부회장, ‘자랑스러운 동아인’ 선정
- [동정]전남대병원 윤숙정 교수, 대한피부과학회 ‘해관 오긍선학술상’ 수상