크론병 치료제 ‘엔티비오’, 다케다 견인차 되나
다케다 매출 1위 품목 등극, 2018년까지 매출 20억 달러 넘길 것!
- 김윤미 기자 kym@medifonews.com
- 등록 2017-03-08 05:40:00
 다케다가 개발한 궤양성 대장염 및 크론병 치료제 '엔티비오(ENTYVIO®, 성분명: 베돌리주맙, 킨텔레스주)'가 주목된다.
다케다가 개발한 궤양성 대장염 및 크론병 치료제 '엔티비오(ENTYVIO®, 성분명: 베돌리주맙, 킨텔레스주)'가 주목된다.
7일 메디포뉴스가 다케다의 엔티비오 제품홈페이지와 글로벌경영공시자료를 조사한 결과, 2014년 5월 미 FDA와 EU 승인을 시작으로 본격적인 글로벌 마케팅을 시작한 ‘엔티비오’가 2017년 현재 다케다를 이끄는 견인 품목으로서의 역할을 톡톡히 하고 있다.
다케다제약이 발표한 2016년 분기별 리포트에 따르면 엔티비오의 지난 한 해 3분기(4월~12월) 글로벌 수익이 1,028억 엔(9.03억 달러)로 전년 동기 수익 대비 434억 엔(3.81억 달러) 증가했다. 73.2% 성장률을 보이고 있는 것이다.
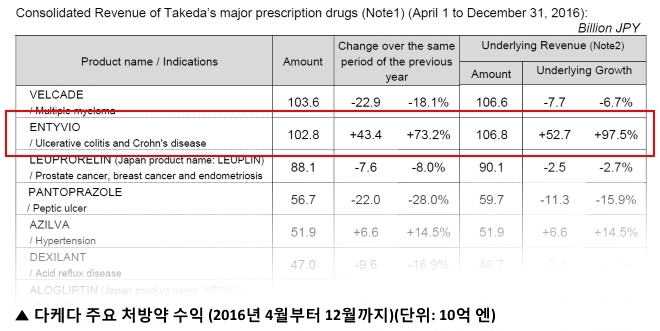
지난 1월 9일 개최된 J.P. Morgan Healthcare Conference 2017에서 다케다제약이 발표한 성장 전략에 따르면 엔티비오의 2018년 연간 매출을 20억 달러 이상으로 끌어올린다는 계획이다. 55개국에서의 엔티비오 승인, 연평균 10억 달러 이상의 매출을 내며 다케다 매출 1위 상품으로 등극했다는 점, 엔티비오로 초치료를 받는 환자의 증가 추이 등을 설명하며 엔티비오의 청사진을 그렸다.
이런 호재 가운데 최근 엔티비오(성분명: 베돌리주맙, 이하 성분명 표기)의 장기 안정성 데이터 분석이 나오며 탄탄한 안정성 프로파일을 갖춰나가고 있다.
다케다제약은 현재 진행 중인 베돌리주맙(Vedolizumab)에 대한 GEMINI 장기 안전성 임상 연구의 5년 중간 분석 결과를 지난 2월 15일부터 18일까지 스페인 바르셀로나에서 열린 제12회 유럽 크론병 및 대장염학회에서 발표했다.
발표된 내용에 따르면 베돌리주맙이 치료 5년째에도 활성 궤양성 대장염 및 크론병 환자에게 장기적인 임상 반응 및 관해를 보였으며, 건강 관련 삶의 질도 개선한 것으로 나타났다.
베돌리주맙 장기 안전성 연구는 중등도에서 중증의 활성 궤양성 대장염 및 크론병 환자를 대상으로 베돌리주맙의 장기 안전성을 평가한 진행 중인 오픈 라벨, 전향적 연구이다.
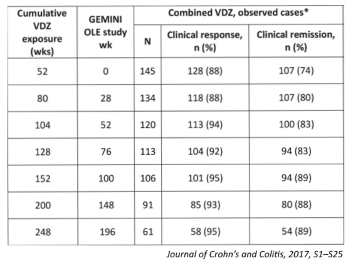 GEMINI I 임상연구에서는 총 154명의 중등도에서 중증의 활성 궤양성 대장염 환자, GEMINI II 임상연구에서는 총 146명의 중등도에서 중증의 활성 크론병 환자를 대상으로 진행했다. 그중 5년 동안 지속적으로 베돌리주맙 치료를 받은 활성 궤양성 대장염 환자는 63명으로 이 중 98%가 임상적 반응을 보였으며, 90%가 임상적 관해에 도달했다. 또 크론병의 경우 5년간 지속적으로 베돌리주맙 치료를 받은 61명의 환자 중 95%가 임상적 반응을 보였으며, 89%가 임상적 관해에 도달한 것으로 나타났다.
GEMINI I 임상연구에서는 총 154명의 중등도에서 중증의 활성 궤양성 대장염 환자, GEMINI II 임상연구에서는 총 146명의 중등도에서 중증의 활성 크론병 환자를 대상으로 진행했다. 그중 5년 동안 지속적으로 베돌리주맙 치료를 받은 활성 궤양성 대장염 환자는 63명으로 이 중 98%가 임상적 반응을 보였으며, 90%가 임상적 관해에 도달했다. 또 크론병의 경우 5년간 지속적으로 베돌리주맙 치료를 받은 61명의 환자 중 95%가 임상적 반응을 보였으며, 89%가 임상적 관해에 도달한 것으로 나타났다.
궤양성 대장염 환자의 경우 증상을 나타내는 부분 메이요 점수(Partial Mayo Score, PMS)가 2점 이상 감소하고, PMS가 기저치 대비 25% 이상 변화하였으며, 직장 출혈 항목점수가 기저치 대비 1점 이상 감소 또는 절대적 직장 출혈 항목점수가 1점 이하인 환자를 ‘임상적 반응’을 보인 환자로 평가했다. 또 1점을 초과하는 개별 항목점수가 없으면서 PMS 점수가 2점 이하인 경우에는 ‘임상적 관해’로 정의했다. 크론병 환자에서는 증상을 나타내는 하비-브래드쇼 점수가 기저치에서 3점 이상 감소한 경우 ‘임상적 반응’을 보인 것으로, 4점 이하인 경우 ‘임상적 관해’로 정의했다.
한편, GEMINI I과 II에 등록한 궤양성 대장염 환자 중 54명이, 크론병 환자 중 58명이 데이터 컷오프가 이루어지기 전에 치료를 중단(각각 19명, 11명이 치료 이득 부족으로 치료 중단)했으며, 5년 평가 기간까지 도달하지 못한 궤양성 대장염 환자가 37명, 크론병 환자가 27명이었다.
베돌리주맙을 통한 장기적인 치료는 환자의 건강 관련 삶의 질 개선과도 관련이 있는 것으로 나타났다. 이는 염증성장질환조사표(IBDQ, Inflammatory Bowel Disease Questionnarie)와 삶의 질 시각적 상사 척도(EQ-5D VAS, Euro Quality of Life-5D visual analogue scale)를 활용해 측정했다. 또한 베돌리주맙의 안전성 프로파일은 지난 3년차 중간 분석 결과와 일치했다.
벨기에 루벤 대학병원의 세버린 퍼메이르(Severine Vermeire) 교수는 “이번 결과는 중등도에서 중증의 활성 궤양성 대장염 및 크론병 성인 환자에게 장기적인 치료 옵션으로 베돌리주맙의 일관성 있는 안전성 프로파일과 효과를 잘 보여주고 있다”며 “해당 질환으로 고통 받는 사람들을 위해 베돌리주맙의 잠재적 이득을 보여줄 수 있는 데이터가 나왔다는 점에서 매우 고무적이다”라고 덧붙였다.
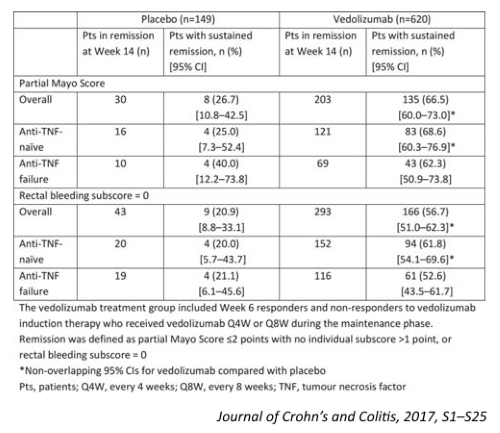
한편, 함께 발표된 GEMINI I 임상연구의 사후분석 데이터에 따르면, 베돌리주맙군(620명)이 위약군(149명)에 비해 14주차에 임상적 관해에 도달했던 환자들에서 지속적인 관해에 도달하는 데에 있어 유의하게 더 효과적인 것으로 나타났다(Table 3). 이때 지속적인 관해는 임상적 관해(1점을 초과하는 개별 항목점수 없이 PMS 2점 이하)와 직장 출혈 항목점수가 26주, 38주, 52주에서 동일하게 0점인 것으로 정의하였다.
이번 분석에는 두 번의 베돌리주맙 유도 치료에 반응을 보였고 46주간 유지요법을 위해 위약이나 베돌리주맙을 투여 받은 GEMINI I 임상연구에 등록되었던 환자들이 포함됐다. 베돌리주맙 유지요법 결과 14주부터 52주까지 계속해서 임상적 관해를 달성한 환자는 60%였던 반면, 휴약 기간(placebo washout)을 가진 환자군에서는 37%만이 임상적 관해에 도달하였다.
이외에도 베돌리주맙의 다양한 리얼월드 데이터 분석결과가 함께 발표됐는데, 본 결과에서도 궤양성대장염 및 크론병 환자에 대한 우호적인 위험 대비 이득 프로파일을 확인할 수 있었다.
이 체계적 리뷰와 메타분석에서는 메드라인(MEDILINE), 코크란(Cochrane), 엠베이스(Embase)에 등록된 논문 및 학회 초록(10명 이상)에 대해 2014년 5월 1일부터 2016년 10월 31일까지 베돌리주맙의 리얼월드 효과를 보고한 연구에 대한 검색이 수행됐다.
총 98건의 연구결과가 검색됐으며, 1,714명의 환자(궤양성 대장염 환자 703명, 크론병 환자 1,010명) 대상, 1년의 치료기간에 걸친 임상적 반응 및 관해에 관한 20건의 코호트 연구가 있었다.
대부분의 베돌리주맙 환자(71% 이상)는 항-종양괴사인자(TNF) 치료를 한 번 이상 받은 경험이 있었다. 결과 측정에는 PMS, 단순 임상적 대장염 활성도 지수, 하비-브래드쇼 점수, 크론병 활성도 지수 및 의사종합평가가 포함됐다.
다케다제약은 환자와 의료진을 위한 지속적인 지원을 목표로 중등도에서 중증의 활성 궤양성 대장염 및 크론병 환자에 대한 베돌리주맙의 진행 중인 연구를 계속해 나갈 예정이라고 밝혔다.
글로벌 판매 4년차에 접어든 ‘엔티비오’의 성적에 다케다는 꽤 만족하는 눈치다. 기업의 성장 전략 제1과제 품목으로 ‘엔티비오’를 꼽았으니 말이다.
위장관계 염증 질환에 있어 존슨 앤 존슨의 ‘레미케이드와 ‘심포니’, 애브비의 ‘휴미라와 함께 삼각구도의 한 축을 담당하는 다케다의 ‘엔티비오’가 향후 어떤 행보를 보일지 주목할 만하다.
- [동정]동산병원 바이오브레인엔지니어링 연구팀, 대한뇌혈관내치료의학회 ‘SCIE 부문 학술상’ 수상
- [인사]GC녹십자의료재단, 김선주 영남센터 원장 임명
- [인사]경희의료원·강동경희대학교병원 원장인사(3/1)
- [동정]경상국립대학교병원 손선우 간호사, 대한간호협회 ‘간호학술상 우수상’ 수상
- [인사]강동경희대학교병원 인사(3/1)
- [인사]엔자임헬스, 컨슈머헬스 PR사업본부 신설 등 인사 단행
- [인사]연세대학교 의료원 인사(3/1)
- [부음]이순주 한양대병원 진단검사의학과 과장 시모상
- [부음]이주흥 성균관의대 교수 모친상
- [부음]강종환 대원제약 해외사업부 이사 부친상
- [동정]동산병원 바이오브레인엔지니어링 연구팀, 대한뇌혈관내치료의학회 ‘SCIE 부문 학술상’ 수상
- [동정]경상국립대학교병원 손선우 간호사, 대한간호협회 ‘간호학술상 우수상’ 수상
- [동정]이대서울병원 백세현 교수 연구팀, APBCS ‘최우수 초록 포스터상’ 수상
- [동정]경북대병원 피부과 윤효진 전공의, 대한피부외과학회 '우수 구연상' 수상
- [동정]이대서울병원 이정무 교수, 제25회 한미수필문학상 ‘장려상’ 수상
- [동정]국립암센터 국가암데이터센터 안재우 연구원, 2026 한국유전체학회 우수포스터상 수상
- [동정]길병원 신영인 교수, 아태안과학회(APAO) 우수 포스터상 수상
- [동정]명지병원 김현수 교수, ‘한재선행상’ 수상
- [동정]유준하 동화약품 대표, 의약품수출입協 보건복지부장관 표창
- [동정]서울성모병원 강진형 교수, 35년 암 치료 여정 담은 에세이 출간













