심평원, DUR 점검기준 개선으로 안전한 의약품 사용환경 강화
DUR 시스템에 임부금기 예외사유 코드 신설 등 개정내용 적용
- 김경애 기자 seok@medifonews.com
- 등록 2018-07-31 09:53:27
 건강보험심사평가원(이하 심사평가원)이 안전한 의약품사용 환경 조성을 위해 '의약품 정보의 확인 및 정보시스템 운영 등에 관한 지침'을 개정하여 오는 8월 1일부터 DUR 시스템에 적용한다고 전했다(아래 별첨 '의약품 정보의 확인 및 정보시스템 운영 등에 관한 지침 개정 안내').
건강보험심사평가원(이하 심사평가원)이 안전한 의약품사용 환경 조성을 위해 '의약품 정보의 확인 및 정보시스템 운영 등에 관한 지침'을 개정하여 오는 8월 1일부터 DUR 시스템에 적용한다고 전했다(아래 별첨 '의약품 정보의 확인 및 정보시스템 운영 등에 관한 지침 개정 안내').주요 개정내용은 ▲임부금기 예외사유 코드 신설 ▲허가사항 관련 주의 의약품 점검기준 신설 ▲동일성분 중복의약품에 대한 점검기준 개선이다.
기존에는 임부금기 의약품을 부득이하게 처방 · 조제할 경우 DUR 시스템에 '예외사유'를 텍스트 형식으로 기재하게 돼 있어, 부적절한 내용이나 형식적인 예외사유를 기재하는 경우가 다수 발생해 국회에서도 이에 대한 지적과 대책 마련을 요구한 바 있다.
이에 심사평가원은 전송된 임부금기 의약품 예외사유 전체 건의 처방행태를 분석하고 약물 위해성 등을 고려하여 의 · 약학적으로 타당한 예외사유를 분류했고, 이를 코드화해 '임부금기 예외사유 코드'를 마련했다.
또, 그간 DUR에서는 식약처 고시 및 공고에 따른 금기의약품 등에 대한 정보만 제공해왔으나, 의약단체 등에서 의약품 허가사항에 대한 정보도 제공해 달라고 요청함에 따라 허가사항 내 성별, 1일 최대용량, 용법 · 용량 등의 '약제 허가사항 관련 주의 의약품' 점검 기준 시스템을 새롭게 신설했다.
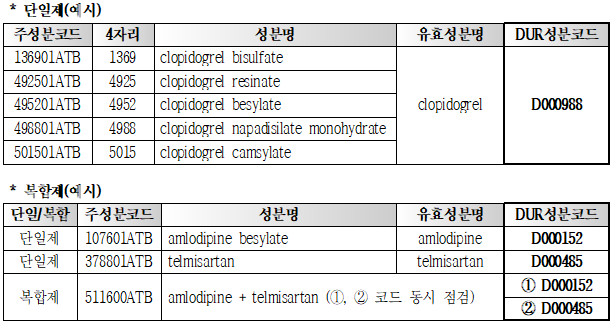
현재 DUR에서는 '약제급여목록 및 급여상한금액표'의 주성분코드 1~4번째가 같으면 동일성분 중복의약품으로 점검되고 있어, 동일 유효성분이지만 염 등이 다르거나 복합제인 경우 주성분코드가 달라 실제로 동일성분 중복이 발생함에도 정보제공이 되지 않아 DUR 점검이 미흡하다는 지적이 있었다.
이에 심사평가원은 급여목록표의 모든 주성분코드에 대해 실질적인 유효성분을 검토 후 약 3천 2백여 개의 'DUR 성분코드'를 개발하여 그동안 점검되지 않았던 염 등이 다른 동일성분 단일제 간, 단일제 · 복합제 간, 복합제 · 복합제 간의 점검이 가능하다.
단, 복합제의 경우 단계적으로 확대하여, 2019년 1월부터는 모든 복합제에 적용 예정이다.
이밖에 세부 개정내용은 심사평가원 요양기관업무포털(http://biz.hira.or.kr>모니터링>DUR정보>DUR안내>공지사항)에서 확인할 수 있다.
심사평가원 유미영 DUR관리실장은 "이번 DUR 점검 기준개선은 그간 국회 및 의약단체 등에서 제기한 점검 사각지대를 개선하고 적정한 사유 기재 및 기준정보 사전안내를 통해 사용자의 편의를 높임으로써 안전한 의약품 사용과 요양기관의 적정청구를 유도하기 위해 추진됐다."며, "DUR을 사용하는 의 · 약사의 적극적인 협조를 부탁드리고, 앞으로도 DUR 시스템을 활용해 환자 안전관리에 기여할 수 있는 다양한 방안을 마련하겠다."고 말했다.
참고자료
- 의약품 정보의 확인 및 정보시스템 운영 등에 관한 지침 개정 안내.hwp / 자료 제공: 건강보험심사평가원
- [부음]강종환 대원제약 해외사업부 이사 부친상
- [동정]이대서울병원 백세현 교수 연구팀, APBCS ‘최우수 초록 포스터상’ 수상
- [동정]경북대병원 피부과 윤효진 전공의, 대한피부외과학회 '우수 구연상' 수상
- [인사]연세대학교 의료원 인사(3/1)
- [인사]경희의료원 인사(3/1)
- [동정]이대서울병원 이정무 교수, 제25회 한미수필문학상 ‘장려상’ 수상
- [동정]국립암센터 국가암데이터센터 안재우 연구원, 2026 한국유전체학회 우수포스터상 수상
- [동정]길병원 신영인 교수, 아태안과학회(APAO) 우수 포스터상 수상
- [동정]명지병원 김현수 교수, ‘한재선행상’ 수상
- [동정]유준하 동화약품 대표, 의약품수출입協 보건복지부장관 표창
- [동정]이대서울병원 백세현 교수 연구팀, APBCS ‘최우수 초록 포스터상’ 수상
- [동정]경북대병원 피부과 윤효진 전공의, 대한피부외과학회 '우수 구연상' 수상
- [동정]이대서울병원 이정무 교수, 제25회 한미수필문학상 ‘장려상’ 수상
- [동정]국립암센터 국가암데이터센터 안재우 연구원, 2026 한국유전체학회 우수포스터상 수상
- [동정]길병원 신영인 교수, 아태안과학회(APAO) 우수 포스터상 수상
- [동정]명지병원 김현수 교수, ‘한재선행상’ 수상
- [동정]유준하 동화약품 대표, 의약품수출입協 보건복지부장관 표창
- [동정]서울성모병원 강진형 교수, 35년 암 치료 여정 담은 에세이 출간
- [동정]애브비, 24회 GPTW ‘대한민국 일하기 좋은 100대 기업’ 8위에 선정
- [동정]바이엘 코리아, 2026 대한민국 일하기 좋은 100대 기업 26위 선정










