생동재평가, 뉴스타틴정 등 14개 품목 부적합 판정
식약청, 2007년재평가결과 2095품목 중 적합판정 869품목
- 전유미 기자 yumi5596@medifonews.com
- 등록 2009-03-26 14:04:55
대웅제약 대웅심바스타틴정20mg, 삼진제약 뉴스타틴정 등 14품목이 생물학적동등성 재평가 결과 부적합 판정을 받아 허가 취소됐다.
식약청은 글리클라짓 등 20개 약효성분 총 2,095품목에 대한 생물학적동등성 재평가결과 등 2007~2008년 실시한 의약품 재평가 결과를 27일 공시했다.
식약청에 따르면, 2007년 생동성 재평가결과 총 2095품목 중 적합판정 869품목, 부적합 14품목, 재평가자료미제출 등 1212품목으로 확인됐다.
또한 2008년 문헌 재평가결과 총 1995품목 중 적합판정 1251품목, 부적합 3품목, 재평가자료미제출 등 741품목으로 나타났다.
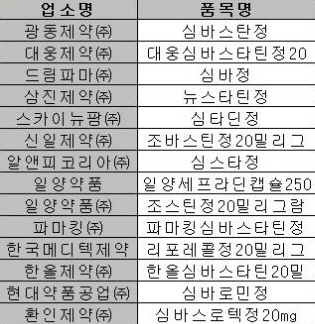
허가취소된 14품목에는 광동제약의 심바스탄정, 대웅제약의 대웅심바스타틴정20mg, 드림파마의 심바정, 삼진제약의 뉴스타틴정, 스카이뉴팜의 심타딘정, 신일제약의 조바스틴정20mg, 알앤피코리아의 심스타정, 일양약품의 일양세프라딘캡슐250mg·조스틴정20mg, 파마킹의 파마킹심바스타틴정, 한국메디텍제약의 리포레콜정20mg, 한올제약의 한올심바스타틴20mg, 현대약품의 심바로민정, 환인제약의 심바스로텍정20mg 등으로 확인됐다.
이와함께 문헌재평가 허가취소 3품목에는 조선무약의 솔표두충환, 지피제약의 보아, 한국약품의 한국늘편환 등이다.
식약청 관계자는 “재평가자료 미제출 품목 및 재평가결과 부적합 품목에 대하여는 허가취소 및 시중 유통품을 수거.폐기 조치한다”면서 “의약품 재평가는 이미 허가된 의약품에 대하여 최신의 과학 수준에서 안전성 및 유효성을 재검토·평가하거나 의약품동등성을 입증함으로써 보다 안전하고 우수한 의약품을 공급하고, 의약품의 합리적인 사용을 기하여 국민보건 향상에 이바지하기 위한 것”이라고 밝혔다.
- [인사]순천향대 부천병원 김철희 교수, ‘대한당뇨병학회 신임 회장’ 취임
- [동정]경북의사회, 적십자 ‘명예대장’ 및 경북사회복지공동모금회 표창 수상
- [동정]충남대병원 정혜선 대전·충남 권역심뇌혈관질환센터장, 교육부장관 표창
- [동정]가천대 길병원 조자윤 교수, 해양경찰청장 감사장
- [인사]휴메딕스, 신임 연구개발본부장에 최승인 상무 선임
- [동정]보라매병원 김원 교수, 2025년도 ’서울대학술연구교육상(연구부문)’ 수상
- [부음]정수용 루시아치과 원장 부친상
- [동정]인천성모병원, 의료관련감염병 지역 의료기관 네트워크 운영사업 우수상 수상
- [동정]해운대백병원 박병규 교수, 대한정형외과학회 국제학술대회 ‘학술본상’ 수상
- [인사]성균관의대 김태진 교수, 대한면역학회 제44대 회장 취임
- [동정]경북의사회, 적십자 ‘명예대장’ 및 경북사회복지공동모금회 표창 수상
- [동정]충남대병원 정혜선 대전·충남 권역심뇌혈관질환센터장, 교육부장관 표창
- [동정]가천대 길병원 조자윤 교수, 해양경찰청장 감사장
- [동정]보라매병원 김원 교수, 2025년도 ’서울대학술연구교육상(연구부문)’ 수상
- [동정]인천성모병원, 의료관련감염병 지역 의료기관 네트워크 운영사업 우수상 수상
- [동정]해운대백병원 박병규 교수, 대한정형외과학회 국제학술대회 ‘학술본상’ 수상
- [동정]순천향대 부천병원 이유경 교수, ‘2025 범부처 의료기기 R&D 어워즈’ 공로상 수상
- [동정]전북대병원 강옥경·유지혜 약사, 한국병원약사대회서 수상
- [동정]강남세브란스병원 최웅락 교수, 한국녹내장학회 ‘연암학술상’ 수상
- [동정]현대약품 황이순 부사장, 환경관리 분야 충청남도지사 표창 수상