재심사 완료되는 심혈관계 제네릭에 허가 몰려
작년 공동-위탁생동 허용으로 제네릭 201건…30% 감소
- 조민규 기자 kioo@medifonews.com
- 등록 2013-02-12 13:38:28
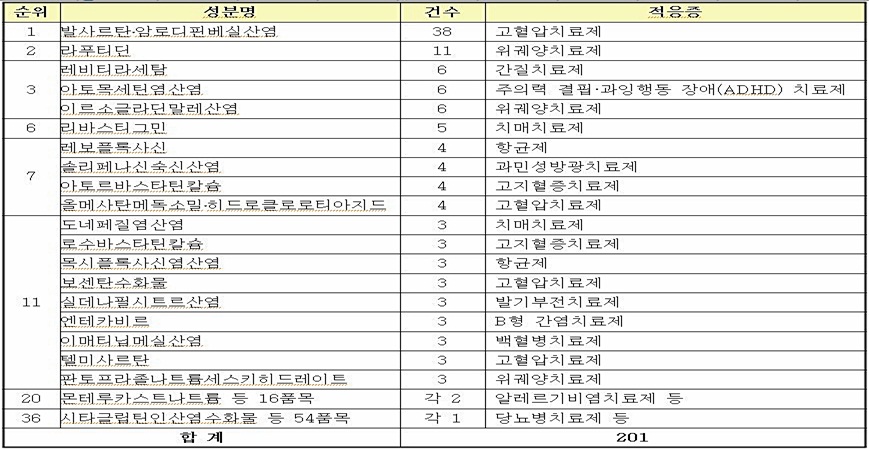
식품의약품안전청은 ’12년 제네릭의약품 개발을 위한 ‘생물학적 동등성시험’ 승인현황 분석한 결과, 승인건수는 201건으로 ’11년(292건)에 비해 30%정도 감소했다고 밝혔다.
승인건수 감소는 ‘11년 말부터 허용된 1개의 제약사가 시행한 생물학적 동등성시험결과를 다른 제약사에서 활용할 수 있는 공동생동 및 위탁생동에 따른 것으로 분석됐다.
식약청은 ‘12년 제네릭의약품의 개발 동향은 ’12년 하반기 또는 ‘13년 상반기에 재심사 등이 만료되는 의약품을 중심으로 고혈압 등 심혈관계 의약품, 현대 사회의 스트레스 증가로 인한 정신신경계 의약품 및 소화계 의약품 개발에 집중되고 있다고 설명했다.
치료영역별 승인건수는 심혈관계의약품 82건(41%), 신경계의약품 36건(18%), 소화계의약품 28건(14%) 등의 순서로 많았다.
심혈관계의약품의 경우 고혈압치료제 개발(66건)이 활기를 띄면서 ‘11년(29건)에 비해 약 180% 증가하여 상승폭이 가장 컸다.
또 위궤양치료제 등 소화계의약품의 경우에도 재심사기간 만료 및 스트레스와 불규칙한 식습관으로 인한 소화기계 질환 등의 증가로 ‘12년 28건으로 ’11년(11건)에 비해 약 150% 상승했다.
반면 골다공증치료제와 같은 대사성의약품의 경우에는 시장 점유율이 높은 ‘이반드론산’ 등과 같은 성분의 재심사가 대부분 ‘11년에 만료되어 ‘11년에는 123건로 가장 많이 승인됐으나 ’12년에는 12건로 가장 많이 감소했다.

성분별로는 고혈압치료제가 66건(33%)으로 가장 많았으며, 특히 복합제가 48건으로 대부분을 차지했다. 복합제 중에는 올해 상반기에 재심사가 만료되는 ‘발사르탄·암로디핀베실산염 복합제’(엑스포지정)의 승인이 38건으로 가장 많았다.
소화성궤양치료제에서는 ‘라푸티딘’(스토가정)이 11건으로 많이 승인됐으며, 간질치료제 ‘레비티라세탐’(케프라정), 과잉행동 장애(ADHD)치료제 ‘아토목세틴염산염’(스트라테라캡슐) 및 소화성궤양치료제 ‘이르소글라딘말레산염’(가스론엔정)이 각각 6건씩 승인됐다.
제네릭의약품을 개발을 위해 국내에서 처음으로 생동성시험 승인을 받은 성분은 소화성궤양치료제 ‘이르소글라딘말레산염’(6건), 치매치료제 ‘리바스티그민’(5건), 고혈압치료제 ‘보센탄수화물’(3건), 종양치료제 ‘테가푸르·기메라실·오테라실칼륨 복합제’(2건), 야뇨증치료제 ‘데스모프레신아세트산염’(1건) 등 총 23개로 나타났다.
식약청은 생물학적 동등성시험의 신뢰성 확보를 위해 승인 심사시 피험자 안전 및 부작용 관리를 중점적으로 검토하고, 생동성 시험이 국제 수준으로 수행되도록 적극 지원할 계획이라고 설명했다.
- [인사]서울성모병원 배자성 교수, 대한신경모니터링학회 회장 선임
- [동정]세종충남대병원 김선정 수간호사, 보건복지부 장관 표창
- [인사]브리츠메디, 이신재 신임 대표이사 취임 (12/2)
- [인사]보건복지부 인사 발령
- [인사]순천향대 부천병원 김기운 교수, ‘대한고압의학회 신임 이사장’ 선출
- [동정]한국원자력의학원 우상근 책임연구원, 국무총리 표창 수상
- [동정]경희대병원 박봉진·박창규 교수, 대한뇌신경기능장애연구회 우수연제상 수상
- [동정]대구가톨릭대학교병원, 공공보건의료 성과로 보건복지부 장관상 수상
- [동정]한림대성심병원, ‘급성심장정지조사 유공’ 보건복지부장관 표창
- [동정]건양대병원, 의료관련감염병 대응 유공 질병관리청장 표창
- [인사]서울성모병원 배자성 교수, 대한신경모니터링학회 회장 선임
- [인사]브리츠메디, 이신재 신임 대표이사 취임 (12/2)
- [인사]보건복지부 인사 발령
- [인사]순천향대 부천병원 김기운 교수, ‘대한고압의학회 신임 이사장’ 선출
- [인사]순천향대 부천병원 이종대 교수, ‘대한안면신경학회 제5대 회장’ 선출
- [인사]휴온스그룹, 2026년 정기 임원 인사 실시 (1/1)
- [인사]고대 안암병원 이헌정 교수, 제3대 대한디지털치료학회장 선출
- [인사]노원을지대학교병원, 신임병원장에 김재훈 교수 선임
- [인사]보령 임원승진인사 단행…“전문성 중심 인재 중용”
- [인사]한림대성심병원, ‘두개안면·재건성형 명의’ 김경식 교수 초빙
- [동정]세종충남대병원 김선정 수간호사, 보건복지부 장관 표창
- [동정]한국원자력의학원 우상근 책임연구원, 국무총리 표창 수상
- [동정]경희대병원 박봉진·박창규 교수, 대한뇌신경기능장애연구회 우수연제상 수상
- [동정]대구가톨릭대학교병원, 공공보건의료 성과로 보건복지부 장관상 수상
- [동정]한림대성심병원, ‘급성심장정지조사 유공’ 보건복지부장관 표창
- [동정]건양대병원, 의료관련감염병 대응 유공 질병관리청장 표창
- [동정]멀츠 에스테틱스, 2025 지속가능개발목표경영지수 최우수그룹 선정
- [동정]연세의대 이정윤 교수, 2026 제7회 난소암 컨센서스 컨퍼런스 공동의장 선임
- [동정]원주의과대학 이승현 연구원, 한국보건정보통계학회 학술대회 우수상
- [동정]경희대병원 유명철 교수, 대한안면신경학회 최우수상 수상













