'58g티엠DB업자상담ㅣ☑️텔WB7000⊇문발로또디비|l'검색결과 - 전체기사 중 1,835건의 기사가 검색되었습니다.
상세검색-

대원제약, ‘리토젯정’
대원제약(대표 백승열)은 이상지질혈증 치료제 ‘리토젯정‘ 3종을 출시했다고 7일 밝혔다. 리토젯정은 에제티미브와 아토르바스타틴의 복합제로 원발성 고콜레스테롤혈증 및 동형접합 가족형 고콜레스테롤혈증에 사용되는 치료제다. 에제티미브는 콜레스테롤이 소장에서 NPC1L1이라는 단백질 통로를 통해 인체로 흡수하는 작용을 저해함으로써 콜레스테롤을 감소시켜 주며, 아토르바스타틴은 스타틴 계열의 약물로 콜레스테롤의 전 단계인 메발론산의 생성 과정에서 HMG-CoA 효소를 차단, 콜레스테롤의 합성을 저해한다. 한국지질동맥경화학회의 이상지질혈증 치료 지침에 따르면 스타틴 단독 요법에도 LDL 콜레스테롤이 효과적으로 저하되지 않을 경우 스타틴과 에제티미브의 병합 요법을 권고하고 있다. 리토젯정은 에제티미브/아토르바스타틴 10/10mg, 10/20mg, 10/40mg의 세 가지 종류로 출시됐으며, 1일 1회 식사와 무관하게 복용한다. 약가는 각각 1정당 637원, 808원, 1203원이다. 대원제약 관계자는 “리토젯정은 타 제품군 대비 정제의 크기가 작아 복용 편의성이 높고, 사용 기한은 36개월로 타 제품군에 비해 길다는 장점이 있다“며, “약가도 타 제품군에 비해 경제적인 데
- 대원제약
- 2021.05.07 12:38
-
MSD ‘키트루다’, 폐암환자 1차 치료에서 5년 생존 입증
한국MSD(대표 케빈 피터스)는 자사의 항 PD-1 면역항암제 키트루다의 1차 단독요법(KEYNOTE-024)에 대한 5년 장기 추적 연구 결과가 지난 4월 19일 세계적인 의학저널인 임상종양학저널(Journal of Clinical Oncology)에 게재됐다고 밝혔다. 이는 비소세포폐암 1차 치료에서 면역항암제 효과를 확인한 3상 연구 중 최초이자 유일한 5년 생존 데이터다. KEYNOTE-024 연구는 PD-L1 발현 양성(TPS 50% 이상)이며 EGFR이나 ALK 변이가 없는 전이성 비소세포폐암 환자의 1차 치료에서 키트루다 단독요법과 현재 표준 치료로 사용되는 항암화학요법을 비교한 3상 임상이다. 5년 장기 추적 연구 결과, 키트루다는 사망 위험을 38%(HR=0.62 [95% CI, 0.48-0.81] 감소시켰으며, 전체 생존기간(Overall Survival, OS) 중앙값은 26.3개월(95% CI, 18.3-40.4)로 항암화학요법의 13.4개월(95% CI, 9.4-18.3) 대비 약 2배 더 긴 생존기간 혜택을 확인했다. 5년 생존율(5-year OS rate) 역시 각각 31.9%, 16.3%로 약 2배 향상됐다. 특히 2년간 키트루다
- 노영희 기자
- 2021.05.03 10:10
-
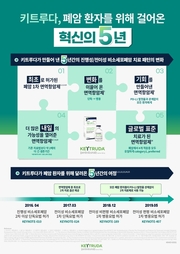
한국 MSD, ‘키트루다’ 국내 허가 5주년 기념 성과 공유
한국MSD(대표 케빈 피터스)는 29일 자사의 항 PD-1 면역항암제 키트루다®의 국내 폐암 허가 5주년을 맞아 키트루다가 그 동안 국내 전이성 비소세포폐암 치료를 위해 개척해 온 성과를 공유했다. 키트루다는 5년 전인, 2016년 4월 29일 진행성 비소세포폐암에서 국내 첫 적응증(KEYNOTE-010)을 허가 받은 뒤, 현재까지 PD-L1 발현율과 관계없이 전이성 비소세포폐암 환자들이 사용할 수 있는 다양한 치료 전략을 제공하면서 국내 폐암 치료에 새로운 패러다임을 제시해왔다. 특히 지난 2017년 초 면역항암제 중 최초로 예후가 나쁜 4기 전이성 비소세포폐암 환자들이 1차에서 바로 면역항암제로 치료를 시작할 수 있도록 허가됨에 따라 면역항암제 치료 시기를 2차 이상에서 1차로 앞당겼다(단독요법/KEYNOTE-024). 이어 면역항암제 치료 옵션에 병용요법을 추가함으로써, 면역항암제 치료 대상을 PD-L1 고발현군에서 전체 환자로 확대시키며 모든 전이성 비소세포폐암 환자들의 표준 치료 옵션으로 자리매김했다. 키트루다는 적응증 확대를 통해 다양한 환자들이 면역항암제를 통해 치료 받을 수 있는 기회를 제공함과 동시에 지속적인 장기 추적 연구를 통해 높은 생존
- 노영희 기자
- 2021.04.29 09:23
-

로슈진단 ‘동반진단 바이오마커’, 폐암 동반진단검사 허가
한국로슈진단(대표이사 조니 제)은 동반진단 바이오마커인 VENTANA PD-L1 (SP142) Assay가 비소세포성폐암(Non-small cell lung cancer, NSCLC)의 동반진단 검사로 지난 4월 15일(목) 국내 허가를 획득했다고 밝혔다. 기존 PD-L1(SP142) 검사는 비소세포성페암(NSCLC)에서 종양세포(TC) 및 면역세포(IC)의 PD-L1의 발현율에 따라 티쎈트릭(TECENTRIQ, atezolizumab) 처방 시 환자의 전체 생존(Overall survival) 예측에 도움을 주는 동반보조진단 검사로 사용됐으나 이번 허가를 통해 티쎈트릭(TECENTRIQ, atezolizumab) 처방 시 환자 선별을 위해 동반진단 검사로 사용할 수 있게 됐다. 동반진단 검사와 동반보조진단 검사는 특정 의약품에 효과가 있는 대상 환자군을 확인할 수 있다는 유사한 임상적 가치를 가지고 있으나 동반보조진단은 치료제에 대한 치료 반응을 예측하는 반면 동반진단 검사는 검사 결과에 따른 의약품의 임상적 유효성을 기반으로 의약품을 처방 받을 수 있는 환자를 선별하는 검사라는 점에서 그 차이가 있다. 지난해 5월, 로슈의 면역항암제 ‘티쎈트릭(TECEN
- 노영희 기자
- 2021.04.27 15:55
-

한국로슈 ‘티쎈트릭’, 전이성 폐암 1차 치료제로 허가
㈜한국로슈(대표이사 닉 호리지)는 4월 15일 자사의 면역항암제 티쎈트릭(성분명: 아테졸리주맙)이 식품의약품안전처로부터 이전에 화학요법치료를 받지않은 PD-L1 발현율 종양세포(TC) ≥ 50 % 또는 종양침윤면역세포(IC) ≥ 10 %으로서, EGFR 또는 ALK 유전자 변이가 없는 전이성 비소세포폐암 환자의 1차 단독 치료 요법으로 허가를 받았다고 밝혔다. 이번 허가는 IMpower110 3상 임상시험을 기반으로 이뤄졌다. IMpower110 연구 결과는 2020년 10월 뉴잉글랜드저널오브메디슨(NEJM, New England Journal of Medicine)에 게재된 바있다. IMpower110 임상시험은 이전에 화학요법치료를 받지 않았으며 PD-L1(TC ≥ 1 % 또는 IC ≥ 1 %) 양성의 편평/비편평 전이성 비소세포폐암 환자를 대상으로 진행됐다. 임상에 참여한 환자군은 티쎈트릭 1200mg 단독 투여군과 화학요법(시스플라틴 또는 카보플라틴 및 페메트렉시드 또는 젬시타빈) 투여군에 1:1로 무작위 배정돼 질병이 진행되거나 허용 불가능한 독성이 발생하거나 임상적 이점이 없을 때까지 치료를 받았다. 1차 평가변수는 전체 환자군(ITT- WT) 중
- 노영희 기자
- 2021.04.19 13:07
-
씨젠, 이탈리아 코로나19 진단키트 공급 계약 체결
씨젠이 이탈리아 정부로부터 약 8937만유로(한화 약 1200억원)에 달하는 코로나19 진단키트 공급 계약을 체결했다. 씨젠 이탈리아 현지법인 ‘Arrow Diagnostics Srl’은 15일 이탈리아 국방부 산하 ‘코로나19 비상대책 위원회(il commissario straordinario per l’emergenza covid-19)’에 코로나19 진단 제품을 공급하기로 했다고 밝혔다. 2014년 이탈리아 현지 법인 설립 이래로 가장 큰 규모의 공식 계약이다. 씨젠 관계자는 “씨젠은 이탈리아에서 이미 독보적인 기술력을 인정받아 이탈리아 전체 코로나19 PCR 진단 시장의 40% 이상을 점유하고 있다”며 “지난해 12월 이탈리아 국가 보조금 관리 기관(Invitalia)에서 주관한 전국 단위 입찰에 성공한 데 이어 다시 한 번 씨젠 제품의 우수성과 차별성을 인정받은 결과”라고 말했다. 이번 계약으로 이탈리아에 공급되는 씨젠의 코로나19 진단키트는 ‘Allplex™ SARS-CoV-2 Assay’로 코로나19 바이러스 유전자 타겟 4개(E, RdRP, N, S gene)에 핵산 추출부터 PCR까지 전 과정 검사 유효성 검증 유전자(Exo IC)를 포함해
- 노영희 기자
- 2021.04.15 13:27
-

쇼그렌증후군, 장내 세균 이용한 면역치료 가능성 제시
특별한 치료제가 없는 난치성 희귀 자가면역질환인 ‘쇼그렌증후군’을 장내 세균 대사산물을 이용해 면역 기능을 조절하는 방식으로 치료할 수 있는 가능성을 제시한 연구 결과가 발표됐다. 가톨릭대학교 서울성모병원 류마티스내과 박성환 교수(공동 교신저자)와 의과대학 의생명과학교실 조미라 교수(공동 교신저자), 김다솜 연구원(제1저자) 연구팀은 쇼그렌증후군 동물모델을 대상으로 장내 균총(gut microbiota)과 연관된 대사산물(부티르산, Butyrate)을 주입해 치료 효과를 확인하고, 부티르산이 면역세포(B세포)의 면역조절 아형(Subtype)을 회복시키고 병인 염증 아형인 인터루킨-17(Interleukin(IL)-17)과 자가항체를 발현하는 세포를 억제하는 이상적인 조절 효과를 확인했다고 밝혔다. 장에는 수많은 미생물과 박테리아가 살고 있는데, 이들은 면역세포의 신호 조절에 중요한 영향을 미친다. 부티르산은 짧은 사슬 지방산(short-chain fatty acid)으로 장내 세균에서 생산되는 대표적인 대사산물이며, 면역기능과 염증 조절에 중요한 역할을 하는 것으로 알려져 있다. 연구팀은 먼저 쇼그렌증후군 동물모델(쥐)을 이용해 쇼그렌증후군 발병 전(4주)과
- 신대현 기자
- 2021.04.12 11:21
-

파멥신 ‘면역관문 억제제’, 미국서 전임상 결과 발표
파멥신(대표 유진산)은 지난 10일(현지사각) 온라인으로 개최되고 있는 2021 미국암연구학회(American Association for Cancer Research; AACR) 연례 학술대회 포스터 세션에서 면역항암제 후보물질 PMC-309의 비임상 결과를 발표했다고 12일 밝혔다. PMC-309는 골수 유래 면역억제세포들(MDSC, M2-macrophages)에서 발현되는 면역관문의 일종인 VISTA(V-domain Ig-containing suppressor of T-cell activation)에 결합해 T 세포의 면역억제 기능을 차단함으로써 종양미세환경에서 T 세포의 활성을 증가시키는 면역관문 억제제다. 해당 물질은 면역항암제의 새로운 표적으로 떠오르는 VISTA와 결합한다는 점과 T 세포가 아닌 면역억제세포의 VISTA에 특이적인 결합력이 높다는 점에서 T세포를 직접 표적하는 기존 PD-1/PD-L1 계열의 약물과 차별점을 가진다. 또한 PMC-309는 약물 효능에 악영향을 미치는 종양미세환경의 저산도(low pH)환경에서도 VISTA에 결합하는 것으로 알려졌다. 이번 AACR에서 발표된 비임상 결과에 따르면, PMC-309는 시험관시험(In-v
- 노영희 기자
- 2021.04.12 09:40
-

[소화기내과] 대장내시경에서 발견되는 톱니상 병변: 어떻게 할 것인가?
서론 대장내시경에서 발견되는 톱니상 병변 (serrated lesion)은 과거에는모두 과증식성 용종 (hyperplastic polyp)으로 진단되어 암으로 진행하지 않는 양성 병변으로간주되었으나, 최근 분자생물학적 연구 결과에 따라 대장암 중 약 30%까지그 발생에 관여하는 전암성 병변 (precancerous lesion)으로 주목을 받고 있다.1~2) 검진 목적의 대장내시경 검사 빈도가 증가하고, 권고된 추적 대장내시경 시기 전에 발생하는 중간암 (intervalcancer)의 임상적, 병태생리학적 특징이 밝혀지면서 대장 톱니상 병변의 진단 및 치료에있어 내시경의 역할에 대한 관심도 늘어나고 있다. 이번 원고에서는 대장내시경 검사 중 흔하게 마주치는대장 톱니상 병변의 내시경적 특징, 진단 및 치료에 대해 알아보도록 한다. 본론 1. 조직학적 정의와 분류 대장 톱니상 병변은 조직학적으로 대장 상피움 (colorectalepithelial crypts)이 ‘톱니 모양(serratedor saw-toothed)’으로 보이는 것을 특징으로 한다.3) 과거에는 대장 용종이 조직학적으로 선종 (adenoma)과 과증식성 용종 (hyperplastic poly
- 천재영
- 2021.04.07 12:29
-

JW생활건강, ‘마이코드 쏘팔메토&옥타코사놀&아연’
JW생활건강의 ‘마이코드(mychord)’가 남성건강을 위한 맞춤형 제품을 선보인다. JW생활건강은 ‘마이코드 쏘팔메토&옥타코사놀&아연’을 출시하고 본격적인 마케팅 활동에 나섰다고 5일 밝혔다. ‘마이코드 쏘팔메토&옥타코사놀&아연’은 전립선 건강, 지구력 증진, 면역력 향상에 도움을 줄 수 있도록 설계한 제품이다. 특히 ‘초임계 추출법’을 활용한 인도산 쏘팔메토를 중심으로 미국산 옥타코사놀, 독일산 아연을 주성분으로 함유해 균형 잡힌 영양을 보충할 수 있다. ‘초임계 추출법’은 자연물에서 특정 성분을 추출하기 위한 공정에 사용하는 방법으로 화학물을 별도로 첨가하지 않아 ‘용매 추출법’보다 진보한 기술로 평가된다. 독성이 없는 이산화탄소를 이용해 저온에서 추출하는 공법으로 프리미엄 제품 원료에 주로 사용된다. 쏘팔메토 열매 추출물은 체내서 테스토스테론을 증가시키는 데 도움을 준다. 옥타코사놀은 심폐지구력 등을 향상시켜 운동 중 피로감을 감소시키며, 아연은 세포분열에 필요한 성분으로 면역기능을 원활하게 한다. ‘마이코드 쏘팔메토&옥타코사놀&아연’은 주성분 외에도 마카추출물, 산수유, 마늘, 복분자, 민들레, 토마토, 홍
- JW생활건강
- 2021.04.05 09:59
-

다케다 ‘알룬브릭’, 비소세포폐암 1차 치료 급여 확대
한국다케다제약(대표 문희석)은 역형성 림프종 인산화효소(Anaplastic Lymphoma Kinase, 이하 ALK) 양성 비소세포성폐암 치료제 알룬브릭®(성분명: 브리가티닙)이 4월 1일부터 ALK 양성 진행성 또는 전이성 비소세포성폐암 1차 치료에도 건강보험 급여가 확대 적용된다고 밝혔다. 알룬브릭®은 2018년 11월 이전에 크리조티닙으로 치료받은 적이 있는 ALK 양성 진행성 또는 비소세포성폐암 치료제로 국내 허가를 받은 후, 2020년 8월 27일 1차 치료제로 적응증을 확대한 바 있다. 이번 급여 확대는 적응증 확대 이후 약 7개월 만에 이루어진 성과로, 이를 통해 ALK 양성 비소세포성폐암 환자의 1, 2차 치료 모두에서 급여가 가능하다. 알룬브릭은 1일 1회 1정 복약만으로 치료 시작 후 약 3개월 전후부터 크리조티닙과 차별화되는 우수한 유효성을 보이며, ALK 양성 비소세포성폐암의 대표적인 미충족 수요인 ‘내성’과 ‘뇌전이’, ‘삶의 질 개선’ 등에서 우수한 임상시험 데이터를 확인했다. 이를 통해 미국종합암네트워크(NCCN, National Comprehensive Cancer Network) 가이드라인에서 ALK 양성 비소세포성폐암 1차
- 노영희 기자
- 2021.04.01 09:26
-

이뮨온시아, 中 기업에 CD47 항체 5400억원 규모 기술 이전
유한양행의 자회사 이뮨온시아(대표 송윤정)는 중국 차세대 면역항암제 개발기업 3D메디슨(3D Medicines)과 총 4억 7050만 달러(약 5400억원) 규모의 기술이전 계약을 체결했다고 31일 밝혔다. 이뮨온시아는 3D메디슨에 CD47 항체 항암신약후보 물질 ‘IMC-002’의 홍콩, 마카오, 대만을 포함한 중국 지역 전용실시권을 허여하는 계약을 체결했으며, 미국, 유럽, 일본 등 중국 외 지역에 대해서는 이뮨온시아가 앞으로도 개발을 진행하면서 기술이전을 추진할 계획이다. 이번 계약으로 이뮨온시아는 3D메디슨으로부터 계약금 800만달러(약 92억원)와 중국 지역 내 임상개발 허가, 상업화, 판매에 따른 마일스톤으로 총 4억 6250만 달러(약 5320억원)의 기술료를 수령하게 된다. 이와 별도로 매출액에 따라 단계별로 최대 두 자릿수의 경상기술료도 지급받는다. 금번 기술이전 계약에 따라 3D메디슨은 중국 내 전용실시권을 가지고 IMC-002에 대한 중국지역에서의 독점적 개발 및 상업화 권리를 획득하게 됐고, 올해 안에 중국 국가약품감독관리국에 임상시험계획(IND)을 제출하는 것을 목표로 개발을 진행할 예정이다. IMC-002는 차세대 면역관문 치료 타깃
- 노영희 기자
- 2021.03.31 12:41
-

[알레르기내과] 비알레르기비염(nonallergic rhinitis): 내과적 치료
서론 비염은 알레르기비염과 비알레르기비염(nonallergic rhinitis)으로크게 분류할 수 있다. 비염 하면 대부분 알레르기라고 생각하지만, 비알레르기도흔하다. 특히, 성인과 노인에서는 비알레르기비염이 많이 관찰된다. 소아를 포함하여 전체적으로 빈도를 보면, 알레르기비염 43%, 비알레르기비염 23%, 이들의 혼합형(mixed) 34% 정도로 보고되어 있다. 1) 알레르기비염과 비알레르기비염은 콧물, 코막힘 등의 증상이 유사하여, 증상 만 가지고는 구별하기 어렵다. 물론 비알레르기비염에서는 재채기, 코가려움, 눈가려움 등이 적은 편이다. 2) 비염 증상이 의심되면 피부단자검사또는 혈청 특이 IgE 검사를 시행하고, 양성이면 증상과관련성을 확인하여 알레르기비염으로 진단한다. 만약, 음성이면비액세포검사를 시행하여 호산구 수를 보고, 증가되어 있으면 비알레르기호산구비염증후군(non-allergic rhinitis with eosinophilia syndrome, NARES)을, 정상이면 혈관운동비염 등의 다양한 종류의 비알레르기비염을 고려해 볼 수 있다.알레르기비염이라도 피부단자검사 또는 혈청 특이 IgE 검사에서 음성을 보이는 경우가 있으며, 이는 특이
- 고영일
- 2021.03.31 10:41
-

외국 치매전문가들도 치매안심병원에 한의사 포함 ‘우려’
치매안심병원 지정 인력 기준에 한방신경정신과 한의사를 포함한 ‘치매관리법 시행령 및 시행규칙 개정안’을 두고 국내 의학계뿐만 아니라 외국 치매전문가들도 이해할 수 없다는 반응이다. 대한신경과학회는 30일 입장문을 통해 “정부 조치에 대해 국내 의학 전문학회들은 강력한 반대 의견을 제출했고, 각종 학술토론을 통해 이러한 사실이 외국에 알려지자 외국 치매전문가들은 큰 우려와 함께 ‘자국에서는 있을 수 없는 일이 한국에서 발생하고 있다’고 성토하고 있다”고 했다. 정부의 이번 개정안을 두고 그동안 신경과학회를 비롯해 대한치매학회, 인지중재치료학회 등 의료계는 반대 입장을 분명히 해왔는데, 관련 소식을 접한 외국 치매전문가들도 우려를 표했다. 일본 Kazunori Toyoda 교수는 “일본에서는 치매전문병원을 한의사에게 맡기는 것은 상상할 수도 없다”며 “한국의 치매관리법 개정안은 치매환자들에게 좋지 않다”고 전했다. 호주 Yukito Shinohara 교수는 “한국의 치매안심병원 개정안은 말도 안 된다. 치매는 복잡한 질환이며 여러 임상과가 종합적으로 치료해야 한다”며 “적절한 진단 과정을 통해서 치료 가능한 원인이 있는지, 어떤 종류의 치매인지 결정하고, 치매약
- 신대현 기자
- 2021.03.30 14:45
-

유한양행, 에이프릴바이오에 100억원 추가 출자
유한양행(대표이사 조욱제)은 SAFA(Serum Albumin Fragment Associated) 기술을 보유한 에이프릴바이오에 100억원을 추가 출자해 기존 보유지분을 더해 2대주주로 등재됐다고 밝혔다. 2013년 설립된 에이프릴바이오는 독자적인 인간 항체 라이브러리 (HuDVFab)기술과 항체 절편 활용 반감기를 증대시킬 수 있는 지속형 플랫폼 기술인 SAFA(Serum Albumin Fragment Associated) 등을 사용해 다양한 치료제 영역에서 글로벌 혁신신약을 개발하는 항체 신약 전문기업이다. 에이프릴바이오는 올해 미국에서 임상1상을 준비중인 자가면역질환 치료제(CD40L 타겟) APB-A1, 전임상 단계인 염증성 자가면역질환 치료제(IL-18 타겟) APB-R3, 남성불임 치료제(FSH 타겟) APB-R2 등을 개발하고 있다. 최근 에이프릴바이오는 유한양행을 대상으로 100억원 규모의 제3자배정 유상증자를 결정했다. 2020년 180억 규모의 시리즈B 투자유치를 했고, 이때 유한양행도 전략적 투자자(SI)로 에이프릴바이오에 30억원을 투자해 4.89%의 지분을 취득한바 있다. 이후 유한양행과 에이프릴바이오는 ‘공동연구 신약개발 업무협약’
- 노영희 기자
- 2021.03.23 09:45
-

AZ ‘타그리소’, 폐암 재발 또는 사망 위험 80% 줄여
“타그리소는 앞으로 폐암 치료에 있어 새로운 지평을 열 것입니다.” 한국아스트라제네카(대표: 김상표)가 3세대 EGFR 변이 비소세포폐암 표적치료제 타그리소의 수술 후 보조요법 적응증 획득 및 국내 출시 5주년을 기념한 온라인 기자간담회를 19일 개최했다. ‘EGFR 변이 비소세포폐암 치료의 패러다임을 선도하는 타그리소’라는 주제로 진행된 이 날 간담회에는 국립암센터 폐암센터 한지연 최고연구원과 연세의대 종양내과 홍민희 교수가 연자로 나서 강연했다. ◆한지연 최고연구원, AURA·FLAURA 연구로 타그리소 가치 조명 첫 번째 세션의 연자 한지연 최고연구원은 지난 5년간 폐암 치료의 패러다임을 바꾸어 온 타그리소의 치료적 가치를 여러 연구를 통해 소개했다. 1, 2세대 EGFR 표적치료제의 무진행 생존기간은 8~15개월로, 중추신경계 전이가 비번하지만 혈액뇌관문 통과가 힘들어 중추신경계 전이 조절이 어렵거나 치료 중에도 중추신경계 전이가 발생한다는 한계를 안고 있었다. 또한 1, 2세대 EGFR-TKI 치료 후 약 3분의 2의 확률로 T790M이라는 이차 돌연변이로 내성이 발생하고 있어 보다 효과적인 치료제의 개발이 필요해왔다. 이런 측면에서 비가역적, 3세
- 노영희 기자
- 2021.03.20 06:04
-

동국제약 폐렴치료제, 코로나 바이러스 증식 억제능력 확인
동국제약(부회장 권기범)이 폐렴 치료제로 쓰이는 항생제 테이코플라닌(Teicoplanin)의 코로나19 바이러스 증식 억제 능력을 확인했다고 18일 밝혔다. 동국제약은 올해 1월, 신종 감염병에 대한 선제적 대응 차원에서 고려대학교 세종산학협력단 및 고려대학교 약학대학과 ‘테이코플라닌의 항코로나바이러스 효능 검증 연구’ 계약을 체결하고 코로나19 항바이러스치료제 개발을 위한 각종 연구를 수행해 왔다. 그 연구결과 최근 베로(Vero) 세포주 효능검색시스템에서 테이코플라닌이 100μM 이하 농도에서도 세포변병효과를 차단하고, 세포 독성이 나타나지 않는 것을 확인했다. 금번 세포시험 결과, 효능농도와 세포독성농도의 차이가 커서, 치료 용량 선택의 폭을 넓게 가질 수 있게 돼 저용량 투여로 경증증상 환자의 증상완화 및 치료는 물론, 고용량의 중증환자 치료까지 효과가 있을 것으로 기대하고 있다. 테이코플라닌은 글라이코펩티드 계열 슈퍼 항생제로 슈퍼 박테리아로 불리는 메치실린 내성 포도상구균(MRSA)과 반코마이신 내성 장구균(VRE)을 효과적으로 제압하는 항생제다. 특히 VRE에 내성을 나타내는 균주에 대한 감수성이 뛰어나고 신독성을 포함한 부작용이 적으며 아직 내
- 노영희 기자
- 2021.03.18 16:02
-

파멥신, 美 학술대회서 PMC-309 전임상 결과 발표예정
파멥신(대표 유진산)은 오는 4월 10일 (미 동부 현지시간) 온라인으로 진행되는 미국암연구학회(American Association for Cancer Research, 이하 AACR) 연례 학술대회 포스터 세션에서 자사의 면역항암 후보물질 PMC-309의 전임상 결과를 발표한다고 11일 밝혔다. PMC-309는 면역관문의 일종인 VISTA(V-domain Ig-containing suppressor of T-cell activation)에 작용하는 물질로, T 세포를 억제하는 골수유래 억제세포(myeloid-derived suppressor cells, MDSC)에 발현된 VISTA에 붙어 면역세포가 암세포를 공격하게 하는 기전을 가지고 있다. T세포를 직접 표적하는 PD-1/PD-L1 계열 약물과 다른 면역 관문을 억제한다는 점에서 차별점을 가진다. 회사 관계자는 “PMC-309는 새로운 면역 관문을 억제한다는 점에서 기존 면역 항암제에 반응하지 않는 환자들을 대상으로 단독 혹은 병용으로 사용될 수 있을 것으로 기대된다”며 “현재 항-VISTA 기전을 보유한 물질 중에는 허가된 약물이 없다는 점에서 혁신신약(First-in-Class)으로 기대되고 있는
- 노영희 기자
- 2021.03.11 10:10
-
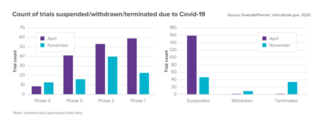
Evaluate가 예측한 제약업계의 2021년은?
코로나19는 지난 한 해 제약 산업의 많은 것들을 바꿨다. 그렇다면 코로나19 백신 접종이 이뤄지고 있는 올해는 어떤 방향으로 나아가게 될까? 제약산업 분석업체 Evaluate는 최근 보고서를 통해 2021년의 제약 업계에 대해 전망했다. 코로나19가 제일 많이 영향을 미친 곳은 임상시험이다. 전세계적으로 코로나19가 유행하기 시작한 2020년 초반 몇 달 동안은 많은 임상시험들이 중단됐으며, 4월에만 거의 160건의 임상시험이 코로나19로 인해 연구가 중단됐다. 이러한 하향세는 11월 무렵 임상 중단 건수가 절반 이상으로 줄어들며 개선됐다. 올해부터는 백신 접종이 시작된 만큼 2021년에는 임상 건수가 늘 전망이다. ◆코로나19 백신·치료제, 올해는 ‘약물재창출’에 주목 코로나19가 전세계적으로 유행하면서 지난 한 해 빠른 속도로 백신 개발이 진행됐다. 모더나를 비롯해 화이자, 아스트라제네카, 노바백스 등 많은 제약사에서 백신 개발을 위해 사활을 걸었다. 전반적으로 코로나19 관련 백신 매출은 내년에 100억달러에서 150억달러에 이를 것으로 보인다. 다만 개발업체들이 이 중 얼마의 매출을 차지할 것인지는 예측하기 어렵다. 치료제 부문을 살펴보면 길리어드의
- 노영희 기자
- 2021.03.11 05:55
-

심평원, 제18기 최고위자과정 수강생 모집
건강보험심사평가원(원장 김선민)은 3월 10일(수)부터 3월 30일(화)까지 3주간 ‘제18기 건강보험심사평가 최고위자과정(H.E.L.P., HIRA Executive Leadership Program)’(이하 ‘최고위자과정’) 수강생을 모집한다. 교육 프로그램은 진료비 심사, 의료질 평가, 의료행위·치료재료·의약품 관리 등 심평원 주요업무와 보건의료정책, 외부인사 특강 등 보건의료 관련 다양한 주제 강의와 자유토론 등 총 14강좌로 구성된다. 최고위자과정은 약 45명의 수강생을 모집하며, 이번 과정은 2021년 4월 29일부터 8월 26일까지 매주 목요일 오후 7시부터 서울 인근 전문교육장에서 진행될 예정이다. 보다 자세한 내용은 심평원 홈페이지(www.hira.or.kr) ‘국민참여 > HIRA교육 > 최고위자과정’에서 확인할 수 있다. 2007년 개설돼 올해로 18기째를 맞는 최고위자과정은 그간 정부, 국회, 법조, 언론, 보건의약계 등 각계·각층 리더 670여명을 배출했으며, 수료생들은 각 분야에서 보건의료 정책과 제도 발전을 위해 다양한 활동을 펼치고 있다. 최고위자과정을 총괄하는 신현웅 기획상임이사는 “건강보험을 넘어 한국 보건의료 분야
- 손락훈 기자
- 2021.03.10 10:20
- [인사]질병관리청 과장급 승진 (9/8)
- [동정]크레스콤 ‘2025 Power Korea 대전’서 보건복지부 장관상 수상
- [동정]보령, ‘기술·경영 혁신대전’ 대통령 표창 수상
- [부음]신지훈 서울아산병원 영상의학과 교수 모친상
- [부음]박현승 前 대한의사협회 총무이사 별세
- [인사]국경없는의사회, 자비드 압델모네임 신임 국제회장 취임 (9/5)
- [동정]삼성바이오에피스, 직업능력개발 관련 고용노동부 장관 표창
- [부음]정신 전남대병원장 장모상
- [인사]보건복지부 과장급 전보 (9/3)
- [동정]대구가톨릭대병원 박기영 교수, 아시아-오세아니아 재활의학회 학술대회서 특별강연·연구발표
- [동정]크레스콤 ‘2025 Power Korea 대전’서 보건복지부 장관상 수상
- [동정]보령, ‘기술·경영 혁신대전’ 대통령 표창 수상
- [동정]삼성바이오에피스, 직업능력개발 관련 고용노동부 장관 표창
- [동정]대구가톨릭대병원 박기영 교수, 아시아-오세아니아 재활의학회 학술대회서 특별강연·연구발표
- [동정]콜마비앤에이치, ‘한국ESG경영대상’ 중견기업 대상 수상
- [동정]원텍, 탈모치료기 ‘헤어빔’으로 2025 올해의 브랜드 대상 7년연속 수상
- [동정]세노비스, 멀티비타민·키즈 비타민 ‘2025 올해의 브랜드 대상’ 수상
- [동정]충남대학교병원 강민웅 교수, 장영실상 수상
- [동정]원텍, ‘올리지오 키스’로 2025 올해의 브랜드 대상 2년연속 수상
- [동정]휴젤, ‘웰라쥬’ 2025 올해의 브랜드 대상 수상













