식약청, 규제개혁과제 추진에 “가속 패달”
1분기, 공장이전-밸리데이션 동시 허용 등 8건 완료
- 전유미 기자 yumi5596@medifonews.com
- 등록 2009-05-06 05:35:02
식약청의 규제개혁과제 추진상황 확인결과 현재까지 8건의 과제를 완료해 1/4분기에만 114.3%의 완료율을 보인 것으로 나타났다.
이에 식약청은 이같은 규제개혁 과제의 성공적인 달성으로인해 1분기에만 업계는 수천억원의 수익창출과 기업부담 및 행정비용 절감 등의 성과를 얻었다고 평가했다.
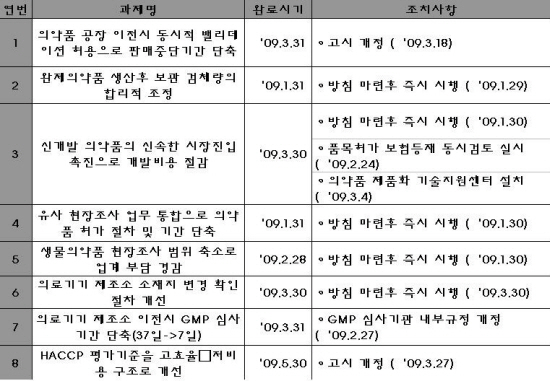
식약청이 발표한 규제개혁과제 추진상황에 따르면, 전체과제수 총 59건 중 1/4분기 완료예정과제 7건과 조기완료과제 1건 등 총 8건의 과제를 완료해 전체대비 13.5%의 완료율을 나타냈다.
총 59건의 전체 규제개혁과제 중 1/4분기 완료대상과제로 ▲의약품 공장 이전시 동시적 밸리데이션 허용으로 판매중단기간 단축 ▲완제의약품 생산후 보관 검체량의 합리적 조정 ▲신개발 의약품의 신속한 시장진입 촉진으로 개발비용 절감 ▲유사 현장조사 업무 통합으로 의약품 허가 절차 및 기간 단축 ▲생물의약품 현장조사 범위 축소로 업계 부담 경감 ▲의료기기 제조소 소재지 변경 확인 절차 개선 ▲의료기기 제조소 이전시 GMP 심사 기간 단축(37일→7일) 등 7건을 완료했다.
또한 HACCP 평가기준을 고효율ㆍ저비용 구조로 개선토록 하는 규제개혁 과제를 조기완료해 총 8건의 과제를 완료한 것으로 확인됐다.
식약청은 이같은 규제개혁 성과로, 먼저 의약품 공장 이전시 동시적 밸리데이션 허용으로 의약품의 시장 진입기간을 6개월로 단축해 약3600억원의 수익을 창출했으며, 공장 이전 시 의약품 공급차질의 우려를 해소했다고 밝혔다.
또한, 완제의약품 검체보관량 감소(50%)에 따른 비용 등 100억원의 기업부담을 절감시켰으며, 품목허가 보험등재 동시검토 실시로 의약품의 시장 진입기간 단축으로 약 1600억원의 수익을 창출했다고 식약청은 설명했다.
이와함께 식약청은 지난 3월 의약품 제품화 기술지원센터 설치로 연구개발 중심 환경 조성으로 국산 의약품의 국제 경쟁력을 제고시켰고, 유사현장 조사 업무 통합 등 현장조사 및 임상관리 기능 통합으로 약 8억원의 행정비용을 절감했다고 전했다.
아울러 임상시험실태조사 기관 감소(50→30개) 등 생물의약품 현장조사 범위 축소로 업소의 비용 절감 및 허가 소요시간을 단축하는 성과를 보였다고 식약청은 밝혔다.
- [인사]순천향대 부천병원 김철희 교수, ‘대한당뇨병학회 신임 회장’ 취임
- [동정]경북의사회, 적십자 ‘명예대장’ 및 경북사회복지공동모금회 표창 수상
- [동정]충남대병원 정혜선 대전·충남 권역심뇌혈관질환센터장, 교육부장관 표창
- [동정]가천대 길병원 조자윤 교수, 해양경찰청장 감사장
- [인사]휴메딕스, 신임 연구개발본부장에 최승인 상무 선임
- [동정]보라매병원 김원 교수, 2025년도 ’서울대학술연구교육상(연구부문)’ 수상
- [부음]정수용 루시아치과 원장 부친상
- [동정]인천성모병원, 의료관련감염병 지역 의료기관 네트워크 운영사업 우수상 수상
- [동정]해운대백병원 박병규 교수, 대한정형외과학회 국제학술대회 ‘학술본상’ 수상
- [인사]성균관의대 김태진 교수, 대한면역학회 제44대 회장 취임
- [동정]경북의사회, 적십자 ‘명예대장’ 및 경북사회복지공동모금회 표창 수상
- [동정]충남대병원 정혜선 대전·충남 권역심뇌혈관질환센터장, 교육부장관 표창
- [동정]가천대 길병원 조자윤 교수, 해양경찰청장 감사장
- [동정]보라매병원 김원 교수, 2025년도 ’서울대학술연구교육상(연구부문)’ 수상
- [동정]인천성모병원, 의료관련감염병 지역 의료기관 네트워크 운영사업 우수상 수상
- [동정]해운대백병원 박병규 교수, 대한정형외과학회 국제학술대회 ‘학술본상’ 수상
- [동정]순천향대 부천병원 이유경 교수, ‘2025 범부처 의료기기 R&D 어워즈’ 공로상 수상
- [동정]전북대병원 강옥경·유지혜 약사, 한국병원약사대회서 수상
- [동정]강남세브란스병원 최웅락 교수, 한국녹내장학회 ‘연암학술상’ 수상
- [동정]현대약품 황이순 부사장, 환경관리 분야 충청남도지사 표창 수상