뷰웍스 의료영상 처리 소프트웨어 ‘VXvue’, 미국 FDA 승인 획득
AI 기반 영상처리 솔루션으로 북미 시장 공략 가속화
창사 이래 처음으로 AI 영상처리 기능을 갖춘 소프트웨어로 FDA 개별 허가
- 노영희 기자 nyh2152@medifonews.com
- 등록 2025-11-12 08:55:43
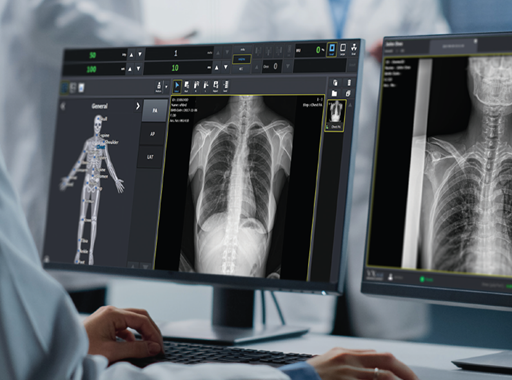
뷰웍스는 창사 이래 처음으로 FDA로부터 AI 기반 영상처리 알고리즘을 포함한 소프트웨어로 승인을 획득했다. 특히 기존보다 강화된 당국의 심사 기준에 맞춰 시판 의료기기와의 동등성, 품질관리 절차와 사후관리 체계를 입증하는 등 기술 역량과 신뢰성을 확보했다.
뷰웍스가 자체 개발한 브이엑스뷰는 엑스레이 디텍터를 통해 획득한 임상 이미지의 송출과 처리를 수행하는 사용자 중심의 소프트웨어다. 임상 이미지의 선명도를 높이는 ‘퓨어임팩트’(PureImpact™) 알고리즘을 탑재해 인체 연조직과 골격의 세부 묘사에 뛰어나다. 이와 함께 인체용, 수의용, 차량내 검진 등 진료 대상과 방식에 따라 세분화된 프리셋을 제공하는 등 편의성을 높였다.
최근에는 다수의 AI 기반 영상처리 솔루션을 내부 기능으로 통합하며 편의성과 사용성을 대폭 강화했다. △흉부 엑스레이 이미지에서 연조직의 가시성을 높이는 ‘본엑스’(Bone-X AI), △딥러닝 기반 알고리즘으로 영상 노이즈를 저감하는 ‘노이즈엑스’(Noise-X AI) 등 분야별로 특화된 기능을 갖췄다.
뷰웍스는 FDA 승인과 유럽 CE 인증 등을 빠르게 늘리며 전 세계적으로 기술력을 인정받고 있다. 지난해 11월 장형 디텍터 ‘VIVIX-S 1751S’, 올해 1월 유방촬영술(맘모그래피)용 엑스레이 디텍터 ‘VIVIX-M 1824S’ 및 ‘VIVIX-M 2430S’에 대해 FDA 승인을 취득했다. 이어 지난 5월에는 슬라이드 스캐너 신제품 VISQUE DPS(Digital Pathology System) LH510에 대해 유럽 체외진단의료기기 인증인 'CE IVDR'을 획득했다.
이를 통해 뷰웍스는 인증 제품들을 주력으로 영업망 확대 및 마케팅에 적극 나선다는 전략이다. 이달 말 북미 최대의 영상의학 전시회 RSNA 2025에서 신소재 엑스레이 디텍터와 신규 영상처리 솔루션이 탑재된 브이엑스뷰 등 FDA 승인 솔루션을 대거 선보일 계획이다.
뷰웍스 관계자는 “이번 FDA 승인으로 뷰웍스는 하드웨어뿐만 아니라 소프트웨어 분야에서도 글로벌 기술 우위를 갖춘 기업임을 증명했다”며, “저선량 방사선 촬영, 병원 내 데이터 관리, 협진 용이성 등 최근 헬스케어 트렌드에 부합하는 고부가가치 제품을 꾸준히 선보이는 한편, 관련 규제 변화에 적극 대응해 나가겠다”고 말했다.
관련기사
- 뷰웍스, ‘RSNA 2025’에서 FDA 허가 기반 통합 솔루션 다수 전시 2025-12-02
- 뷰웍스 정지영상 디텍터 6종, 유럽서 ‘CE MDR’ 인증 획득 2025-11-21
- 뷰웍스, 신입사원 공개채용 (~9/22) 2025-09-01
- 뷰웍스, 슬라이드 스캐너 ‘VISQUE DPS’ 유럽 인증 획득 2025-04-29
- 뷰웍스, ‘USCAP 2025’서 디지털 병리진단 핵심 장비 공개 2025-03-24
- 뷰웍스, 화성사업장 2배 규모로 확장 준공 2025-03-19
- 뷰웍스, SF·AW 2025 전시회 ‘AI 머신 비전 기술 세미나’ 참가 2025-03-17
- 뷰웍스, SF·AW 2025 전시회 ‘AI 머신 비전 기술 세미나’ 참가 2025-03-14
- 뷰웍스, 유럽 영상의학회 ‘ECR 2025’ 서 AI 응용 기술 다수 선봬 2025-02-27
- 뷰웍스, 2024년 매출 2229억원 기록하며 전년 대비 1.2% 상승 2025-02-12
- 뷰웍스, 유방촬영검사용 엑스레이 디텍터 2종 FDA 시판 전 허가 취득 2025-01-20
- 뷰웍스, ‘RSNA 2024’서 AI 기반 솔루션 4종∙장형 디텍터 등 혁신기술 공개 2024-12-03
- 뷰웍스, 올해 1~3분기 수출액 1338억원 달성 2024-11-07
- 뷰웍스, ‘디지털 덴티스트리’ 확산에 동영상 디텍터 성장 뚜렷 2024-09-24
- 뷰웍스, 유럽 병리학 전시회 ‘ECP 2024’ 참가 2024-09-10
- 뷰웍스, ‘2025 신입사원 공개채용’ (~9/23) 2024-09-02
- 뷰웍스, 자체 개발 흉부 AI 진단보조 솔루션 ‘VXCAD-CXR’ 허가 2024-08-20
- 뷰웍스, 1분기 매출액 604억 원 달성하며 전년 동기 대비 10% 성장 2024-05-27
- 뷰웍스, AACR 2024에서 소동물용 광학 인비보 영상 솔루션 최초공개 2024-04-11
- 뷰웍스, 평판형 디텍터 미래 기술 선도 2024-04-09
- 뷰웍스, 2024 스마트공장·자동화산업전 참가 2024-03-28
- 뷰웍스, 유럽 영상의학회에서 신형 디텍터, AI 진단보조 등 솔루션 확대 전시 2024-02-29
- 뷰웍스, 글로벌 수의과 시장 AI 진단보조 솔루션 보급 확대 2024-01-17
- 뷰웍스, 서브마이크로 수준 검사 솔루션 ‘VEO Focus’ 선보여 2024-01-04
- 뷰웍스, ‘RSNA 2023’에서 통합 의료 영상 솔루션 공개 2023-11-28
- 뷰웍스, 화성사업장 2배 규모 증축 기공식 개최 2023-11-20
- 뷰웍스 김후식 대표, 마약범죄 근절 캠페인 ‘NO EXIT’ 동참 2023-11-08
- 뷰웍스, 병리학회 가을학회서 디지털 병리진단 시스템 장비 ‘루체온’ 최초 공개 2023-10-27
- 뷰웍스, 화성사업장 생산능력 2배 규모로 신규 증설 추진 2023-10-12
- 뷰웍스, 중국국제의료기기 전시회 ‘CMEF 2023’ 참가 2023-05-15
- 뷰웍스, 미국암연구학회서 ‘국산 광학 인비보 영상 솔루션’ 홍보 박차 2023-04-18
- 뷰웍스, 독일 치과 전시회 ‘IDS 2023’ 참가 2023-03-20
- 뷰웍스, 상반기 매출 1,176억 달성, 전년대비 29% 성장 2022-08-17
- [부음]허윤 한신약품 부회장 별세
- [동정]연세의대 이정윤 교수, 2026 제7회 난소암 컨센서스 컨퍼런스 공동의장 선임
- [동정]원주의과대학 이승현 연구원, 한국보건정보통계학회 학술대회 우수상
- [동정]경희대병원 유명철 교수, 대한안면신경학회 최우수상 수상
- [동정]고대 안산병원 박형준 교수, 아시아관절경학회 정기학술대회 우수 발표상 수상
- [인사]휴온스그룹, 2026년 정기 임원 인사 실시 (1/1)
- [동정]은평성모병원 최의윤 교수, 보건복지부 장관 표창
- [동정]고대 안산병원 한경화 수간호사, 응급 의료 발전 유공 안산시장 표창 수상
- [동정]서울성모병원 장기이식센터, 아태지역 최대 이식 학술대회 ‘ATW 2025’ 우수 초록상 연속 수상
- [부음]강재수 일암의료재단 삼례고려병원 이사장 별세
- [인사]휴온스그룹, 2026년 정기 임원 인사 실시 (1/1)
- [인사]고대 안암병원 이헌정 교수, 제3대 대한디지털치료학회장 선출
- [인사]노원을지대학교병원, 신임병원장에 김재훈 교수 선임
- [인사]보령 임원승진인사 단행…“전문성 중심 인재 중용”
- [인사]한림대성심병원, ‘두개안면·재건성형 명의’ 김경식 교수 초빙
- [인사]보건복지부 인사 발령 (12/19)
- [인사]을지재단 인사(1/1)
- [인사]SK바이오, 원액생산실장에 조봉준 부사장 선임
- [인사]삼성서울병원 설호준 교수, 대한두개저학회 차기 회장 선출
- [인사]한림대강남성심병원 이근영 교수, 국제주산의학회 이사 임명
- [동정]연세의대 이정윤 교수, 2026 제7회 난소암 컨센서스 컨퍼런스 공동의장 선임
- [동정]원주의과대학 이승현 연구원, 한국보건정보통계학회 학술대회 우수상
- [동정]경희대병원 유명철 교수, 대한안면신경학회 최우수상 수상
- [동정]고대 안산병원 박형준 교수, 아시아관절경학회 정기학술대회 우수 발표상 수상
- [동정]은평성모병원 최의윤 교수, 보건복지부 장관 표창
- [동정]고대 안산병원 한경화 수간호사, 응급 의료 발전 유공 안산시장 표창 수상
- [동정]서울성모병원 장기이식센터, 아태지역 최대 이식 학술대회 ‘ATW 2025’ 우수 초록상 연속 수상
- [동정]한림대의료원 서영균 빅데이터센터장, 보건복지부장관 표창
- [동정]녹십자, ‘LMO 안전관리 우수 기관’ 과기부 장관상 수상
- [동정]서울특별시 서남병원, 2025 공공보건의료 성과보고회에서 ‘보건복지부 장관상’ 수상








