“국내 임상 불붙었다!”…작년 한해 400건 육박
국내사 1상(71건)↔다국적 3상 임상(135건) “많아”
- 전유미 기자 yumi5596@medifonews.com
- 등록 2009-01-22 05:50:26
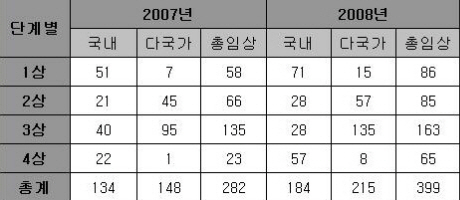
국내제약사와 다국적제약사들의 임상시험 승인건수가 지속적으로 늘고 있어 2008년 의약품 임상승인 건수는 총 399건으로 전년(2007년)대비 117건이 증가한 것으로 나타났다.
20일 식약청이 발표한 2008년 단계별 임상시험 계획 승인현황에 따르면, 지난해 의약품 임상시험 승인건수는 총 399건으로 집계됐으며 국내임상승인 184건, 다국가 임상승인 215건으로 확인돼 국내사와 다국적사가 비등한 임상시험 승인을 받은 것으로 확인됐다.
2008년 의약품 임상시험 승인건수 총 399건 중 3상임상이 163건으로 지난해에 이어 가장 많은 것으로 나타났으며, 이어 1상임상 86건, 2상임상 85건, 4상임상 65건으로 집계됐다. 이중 지난해 대비 임상승인 건수가 가장 많이 증가한 임상은 42건 증가한 4상임상으로 드러났다.
이중 국내 제약사의 임상시험 승인건수는 총 184건으로 전년대비 50건이 증가했으며, 1상 71건, 2상 28건, 3상 28건, 4상 57건으로 나타났다.
이에비해 다국가 임상시험 승인건수는 총 215건으로 전년대비 67건이 증가했으며, 3상이 135건으로 압도적으로 많았으며 이어 2상 57건, 1상 15건, 4상 8건으로 확인됐다.
특히 지난해 임상3상 전체임상 건수는 총 25건이 증가했으나, 2007년에 비해 국내 임상건수는 줄고, 다국가 임상건수는 증가한 것으로 나타났다.
이에 따라 다국적사의 국내 임상은 신약개발 초기단계에서 다국가 임상의 일환으로 실시하는 개발목적 보다는 이미 해외 본사가 개발한 신제품의 국내 임상을 통해 효과의 입증, 국내 런칭을 위한 마케팅 목적의 임상내용이 더 많은 것으로 유추된다.
반면 국내 제약사의 임상은 신약 또는 신제품 개발을 위해 1상부터 단계를 밟는 수순으로 보여진다. 주목되는 점은 임상건수에서 다국적사를 추격하는 양상으로 나타나 국내 제약사들이 제품개발에 매우 역점을 두고 있는 것으로 분석된다.
- [인사]순천향대 부천병원 김철희 교수, ‘대한당뇨병학회 신임 회장’ 취임
- [동정]경북의사회, 적십자 ‘명예대장’ 및 경북사회복지공동모금회 표창 수상
- [동정]충남대병원 정혜선 대전·충남 권역심뇌혈관질환센터장, 교육부장관 표창
- [동정]가천대 길병원 조자윤 교수, 해양경찰청장 감사장
- [인사]휴메딕스, 신임 연구개발본부장에 최승인 상무 선임
- [동정]보라매병원 김원 교수, 2025년도 ’서울대학술연구교육상(연구부문)’ 수상
- [부음]정수용 루시아치과 원장 부친상
- [동정]인천성모병원, 의료관련감염병 지역 의료기관 네트워크 운영사업 우수상 수상
- [동정]해운대백병원 박병규 교수, 대한정형외과학회 국제학술대회 ‘학술본상’ 수상
- [인사]성균관의대 김태진 교수, 대한면역학회 제44대 회장 취임
- [동정]경북의사회, 적십자 ‘명예대장’ 및 경북사회복지공동모금회 표창 수상
- [동정]충남대병원 정혜선 대전·충남 권역심뇌혈관질환센터장, 교육부장관 표창
- [동정]가천대 길병원 조자윤 교수, 해양경찰청장 감사장
- [동정]보라매병원 김원 교수, 2025년도 ’서울대학술연구교육상(연구부문)’ 수상
- [동정]인천성모병원, 의료관련감염병 지역 의료기관 네트워크 운영사업 우수상 수상
- [동정]해운대백병원 박병규 교수, 대한정형외과학회 국제학술대회 ‘학술본상’ 수상
- [동정]순천향대 부천병원 이유경 교수, ‘2025 범부처 의료기기 R&D 어워즈’ 공로상 수상
- [동정]전북대병원 강옥경·유지혜 약사, 한국병원약사대회서 수상
- [동정]강남세브란스병원 최웅락 교수, 한국녹내장학회 ‘연암학술상’ 수상
- [동정]현대약품 황이순 부사장, 환경관리 분야 충청남도지사 표창 수상