주요 제약바이오사, 초기임상 진입 확대…1상>3상
얀센, 작년 4분기 1상∙3상 단계서 최다 건수 승인
- 노영희 기자 nyh2152@medifonews.com
- 등록 2026-01-06 06:00:46
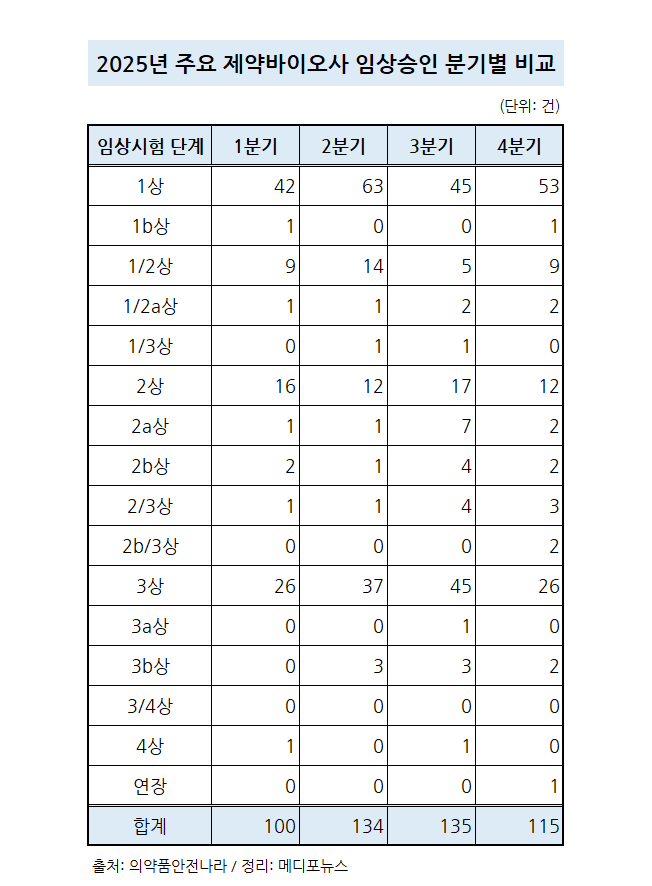
지난 2025년 4분기, 주요 제약바이오사가 식품의약품안전처로부터 승인받은 임상시험이 115건으로 한 해 동안 500건에 가까운 임상시험이 승인된 것으로 나타났다. 특히 4분기에는 기존 임상시험보다는 1상이상 2상미만의 새롭게 시작된 연구들이 많아 향후 신약개발로 이어질 수 있을지 기대가 모이고 있다.
1상이상 2상미만의 단계에서는 휴온스가 5건으로 가장 많은 임상시험을 승인받았다. HUC2-676 임상시험이 1건, HUC2-588 임상시험이 2건, HUC3-660 임상시험이 2건이었다.
한국얀센이 허가받은 임상시험은 약 4건으로 JNJ-61186372 임상시험이 2건, JNJ-89862175 임상시험과 JNJ-95437446 임상시험이 각각 1건씩 승인받았다.
그 중에서도 JNJ-61186372는 ▲전이성 비소세포폐암에서 아미반타맙+올로모라십 병용요법 ▲절제 불가능 전이성 비소세포폐암에서 아미반타맙+카프마티닙 병용요법의 안전성과 유효성을 평가하는 임상시험으로 승인받았다.
2상이상 3상미만의 단계에서는 한국애브비가 승인받은 임상시험이 4건으로 가장 많았다.
이 중 ABBV-400(텔리소투주맙) 임상시험은 총 2건이 승인된 가운데 ▲MET 증폭이 있는 국소 진행성 또는 전이성 고형암 시험대상자의 치료 ▲3세대 EGFR TKI 투여 중 진행 후 국소 진행성 또는 전이성 EGFR 돌연변이 비편평 비소세포폐암 시험대상자의 표준치료와 비교를 위해 연구될 예정이다.
ABBV-706은 아테졸리주맙과의 병용요법으로 승인돼, 이전에 치료받지 않은 확장기 소세포폐암 환자를 대상으로 한 1차치료의 임상적 유효성을 표준요법과 비교하게 된다.
ABT-981과 ABBV-323는 중등증-중증 활동성 류마티스 관절염이 있는 성인 치료를 위한 표적요법 연구로 임상시험을 승인받았다.
한편 3상이상의 단계에서도 한국얀센이 가장 많은 임상시험을 승인받은 것으로 나타났다.
Pasritamig(JNJ-78278343)는 전이성 거세저항성 전립선암 관련 연구 2건을 승인받았고, 구셀쿠맙(CNTO 1959)은 크론병, 궤양성 대장염, 건선성 관절염이 있는 소아를 대상으로 한 연구를 1건 승인받았다.
이코트로킨라(JNJ-77242113-AAC)는 중등증-중증 활성 궤양성 대장염, JNJ-61186372는 치료 경험이 없는 재발성/전이성 두경부 편평세포암 관련 연구로 승인을 받았다.
얀센을 제외하면 한국화이자제약, 한국릴리가 각 3건으로 임상시험을 많이 승인받았다.
화이자가 승인받은 연구 중 PF-06760805는 임부 및 영아 대상 B군 연쇄상구균 다가백신 연구로, PF-07248144, (PF-07220060, PF-07850327)는 CDK4/6i 기반 요법 후 질병이 진행된 호르몬 수용체-양성, HER2-음성 진행성/전이성 유방암 대상 연구로, PF-06821497는 전이성 거세 민감성 전립선암 대상 연구로 승인됐다.
릴리가 승인받은 연구 중 LY3502970임상시험은 오르포글리프론의 영향을 확인하기 위한 연구 2건을 승인받았다. ▲확립된 죽상경화성 심혈관 질환 및/또는 만성신장 질환이 있는 환자에서의 심혈관 사건 발생률 ▲복압성 요실금이 있는 비만 또는 과체중 여성 대상 위약 대비 유효성, 안전성 등이 연구될 예정이다.
관련기사
- 3분기 주요 제약바이오사 임상 135건 승인…노바티스 선두 2025-10-02
- 서울아산병원, 1분기 임상 8건 승인…주요 병원 중 최다 2025-04-02
- 1분기 주요 제약바이오사 임상시험 100건 승인 2025-04-01
- 4분기 임상 침체 속 희귀∙중증질환 3상 승인에 기대감↑ 2025-01-06
- 3분기, 2상단계 임상승인↑…항암제 연구 승인 多 2024-10-04
- 2분기 주요 제약바이오사 임상 130건 승인…MSD 강세 2024-07-01
- 1분기 주요 제약바이오사 임상 134건 승인…3상 이상이 34% 2024-04-02
- 4분기 ‘3상’ 임상승인 최다…출시 기대 약물은? 2024-01-02
- 3분기 임상승인 129건 중 과반이 1상에…어떤 약물 탄생될까 2023-10-04
- 2분기 임상시험, 1상 승인 최다…2상 최저 2023-07-01
- 1분기, 임상 승인건수 적지만 ‘3상 이상’ 우세 2023-04-04
- 4분기, 3상 임상승인 ‘최다’…2023년 출시 임박한 약은? 2023-01-02
- 갈수록 줄어드는 임상 승인, 3분기는 승인건수는 179건 2022-10-04
- 넥스트 국산 백신, 유바이오로직스가 탄생시킬까 2022-09-08
- ‘출시 기대’ 3상 승인된 코로나19 백신·치료제 총 4건 2022-07-11
- 2분기 임상시험 승인 건수는 소폭 감소된 187건 2022-07-04
- 1분기 임상시험 총 288건…작년 대비 1상 증가 2022-04-04
- 임인년 맞아 출시를 기대할 만한 신약은? 2022-01-03
- 3분기 임상시험 총 312건 진행…1·2·3상 모두 증가 2021-10-02
- 2분기 임상 총 286건…1상 늘고 2·3상 감소 2021-07-02
- 제약바이오사 2분기 임상시험, 진행상황은? 2020-07-20
- 서울대병원, 세계적 임상센터의 중심에 서다! 2010-10-12
- 국가임상시험사업단-애보트 MOU 협약 2010-10-08
- 정신질환자 임상시험 중 돌연 자살 '의혹 제기' 2010-10-04
- FDA, 임상시험 중 부작용 즉각 보고규정 마련 2010-10-02
- 서울대병원, 차세대 스텐트 임상시험 대규모 진행 2010-07-19
- 국내 임상시험 “약진”, 다국가 임상시험보다 앞서 2009-11-13
- 국내사 ‘1상’-다국적사 ‘3상임상’ 가장 많아 2009-08-04
- 항암제-당뇨치료제-고혈압제 등 5건 임상승인 2009-06-14
- 아바스틴주 다국가 임상시험 포함 5건 임상 승인 2009-06-06
- 한미약품 “HCP0605-5/50정 등 2건 임상승인 2009-05-16
- “한미약품-화이자” 임상승인 건수 가장 높아 2009-05-11
- 노바스크정다이크로짇정 등 6건 임상시험 승인 2009-05-03
- 한미약품의 “심바스틴씨알정” 임상승인 2009-04-03
- 갈더마코리아 “클로벡스액” 등 8건 임상시험 승인 2009-03-27
- 동아제약, 자체개발신약 DA-1229 임상1상 진입 2009-03-20
- MSD, 코솝점안액 등 3건 임상승인 2009-03-06
- 동국제약 ‘Pio-Met정’ 등 임상시험 7건 승인 2009-02-28
- 중외제약 발기부전치료제 신약 3상임상승인 2009-02-13
- 금주 임상, B형 간염-당뇨약-유방암제 등 4건 2009-02-07
- 대웅제약 “DWP05195정” 등 12건 임상승인 2009-01-31
- 보령 BR-A-657칼륨정-릴리 시알리스, 임상승인 2009-01-17
- 화이자 ‘챔픽스’ 등 13건 임상시험 승인 2008-12-28
- 신풍제약 ‘록스펜주’ 등 임상시험 6건 승인 2008-12-13
- 아트로다캅셀 등 6건 임상시험계획 새로 승인 2008-12-06
- 폐암치료제 ‘티에스원캡슐’ 등 10건 임상시험 승인 2008-09-16
- 식약청, '일라프라졸', '유트로핀주' 임상계획 승인 2008-08-08
- “임상시험 등 각종 시험관련 의견 보내주세요” 2008-07-30
- 응급시 임상시험용약 사용 완화-승인기간 단축 2008-06-19
- [동정]순천향대 부천병원 이유경 교수, ‘2025 범부처 의료기기 R&D 어워즈’ 공로상 수상
- [인사]건양대학교의료원 인사
- [동정]전북대병원 강옥경·유지혜 약사, 한국병원약사대회서 수상
- [인사]GC녹십자웰빙, 정시영 연구개발본부장 영입
- [동정]강남세브란스병원 최웅락 교수, 한국녹내장학회 ‘연암학술상’ 수상
- [인사]신신제약, 정기 승진 인사(1/1)
- [동정]현대약품 황이순 부사장, 환경관리 분야 충청남도지사 표창 수상
- [인사]일동제약, 이재준 사장 공동대표로 선임 (1/5)
- [인사]종근당 정기승진인사 (1/1)
- [인사]노원을지대학교병원, 제20대 김재훈 병원장 취임
- [동정]순천향대 부천병원 이유경 교수, ‘2025 범부처 의료기기 R&D 어워즈’ 공로상 수상
- [동정]전북대병원 강옥경·유지혜 약사, 한국병원약사대회서 수상
- [동정]강남세브란스병원 최웅락 교수, 한국녹내장학회 ‘연암학술상’ 수상
- [동정]현대약품 황이순 부사장, 환경관리 분야 충청남도지사 표창 수상
- [동정]칠곡경북대병원 최병호 교수, 국민교육발전 유공으로 교육부장관 표창 수상
- [동정]중앙대병원, 암환자 자기관리 앱 CAMA+ 연구로 국내외 학술대회 연속 수상
- [동정]경희대한방병원 침구과 이승훈 교수, 보건복지부 장관 표창
- [동정]고대 안산병원 이주한 교수, 기후에너지환경 정책 유공 장관 표창 수상
- [동정]국민건강보험 일산병원 김희선 센터장, 응급의료 유공 보건복지부 장관상 수상
- [동정]고대 안암병원 김영훈 교수, 민간 통일운동 공로로 대통령 표창













