2분기 임상시험 승인 건수는 소폭 감소된 187건
1상시험 국내사, 2·3상시험 외자사 강세…로슈 유방암 치료제 3상 승인
- 노영희 기자 nyh2152@medifonews.com
- 등록 2022-07-04 05:49:46
2분기 임상시험 승인 건수가 예년 대비 감소했다. 세부적으로는 1상시험과 2상시험의 수가 비교적 큰 폭으로 줄어들었으나 3상시험은 비슷한 수치를 유지하고 있다. 또 1상시험에서는 국내 제약사가, 2상시험과 3상시험에서는 다국적제약사가 임상시험 진입에 대해 강세를 보였다.
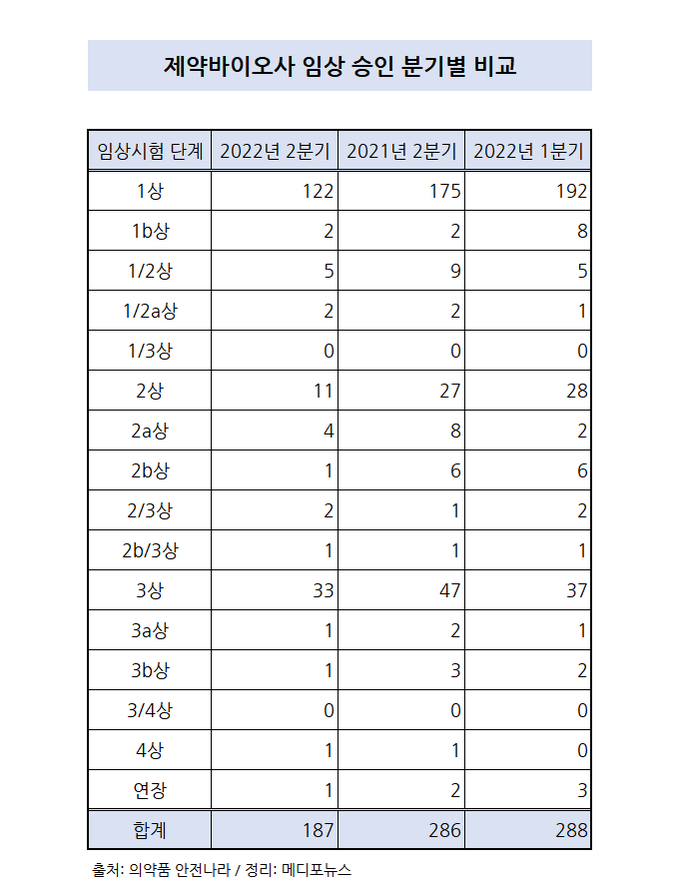
임상 1상시험 승인을 가장 많이 받은 제약사는 휴온스로 2분기에 총 8건에 대한 1상시험 진입에 대해 승인을 받았다.
승인된 제품은 HUC3-443, HUC3-431, HUC3-350, HUC3-342, HUC3-066, HUC3-383과 HUC2-396(2건)이다.
이 중 HUC3-383 임상시험 2건은 건강한 성인 대상자에서 HUC2-396-R1과 HUC2-396-R2를 병용 투여 또는 HUC2-396을 단독 경구 투여 후 안전성과 약동학적 특성을 비교 평가하기 위한 무작위배정, 공개, 단회투여한다는 점에서 임상시험의 조건은 같다.
그러나 각 임상시험은 식후, 2X2 교차 설계 임상시험과 공복, 2X4 교차 설계 임상시험이라는 점에서 서로 다르다.
1상시험 진입 6건을 승인받은 영진약품은 펠프스서방정45mg 2건과 YPI-011 2건, 세포세틸정 1건, 영진세프디토렌피복실세립10% 1건에 대해 승인받았다.
펠프스서방정에 대한 임상시험 2건은 공복과 식후에 대한 조건, YPI-011에 대한 임상시험 2건은 용량에 대한 조건 (10/500mg, 20/500mg) 등에서 차이를 보여 구분된다.
이 밖에도 대원제약은 DWCLDS125, DW5125, DW5122, DW5221, DWCLDS250에 대한 1상시험을 허가받았다.
2상시험에서는 MSD가 3건으로 가장 많이 승인을 받았다. MSD가 허가받은 임상시험은 첫 번째로1.MK-2140 2.MK-1026 임상 2건과 두 번째로 1. MK-4830 2. 키트루다주(펨브롤리주맙, 유전자재조합) 임상시험이다.
1.MK-2140 2.MK-1026를 다루는 첫 번째 임상시험은 공격성 및 지연성 B세포 악성질환 환자를 대상으로 단독요법 및 병합요법으로서의 MK-2140의 안전성과 유효성을 평가하기 위한 다기관, 라벨 공개, 제2상, 바구니형 임상시험이다.
두 번째 임상시험은 DLBCL 환자를 대상으로 R-CHP와의 병합요법으로 투여되는 Zilovertamab Vedotin(MK-2140)을 평가하는 다기관, 라벨 공개, 제2상 단계적 용량 상향·확증 및 유효성 확장 임상시험이다.
1. MK-4830 2. 키트루다주(펨브롤리주맙, 유전자재조합)에 대한 임상시험은 고등급 장액성 난소암에 대한 신보조 치료로서 MK-4830을 병합하거나 병합하지 않은 Pembrolizumab과 화학요법을 평가하는 무작위배정, 제2상 임상시험이다.
3상시험에서는 로슈가 알레센자(RO542-4802/F03 and /F16), 새트랠리주맙, Crovalimab (RO7112689), Giredestrant (GDC-9545) 총 4건에 대한 임상 승인을 받았다.
이 중 Giredestrant (GDC-9545)가 이전 치료 경험이 없는 HER2 양성, 에스트로겐 수용체 양성 국소 진행성 또는 전이성 유방암 환자에서 페스코 + 탁산계 약물 유도요법 후 페스코 대비 지레데스트란트 + 페스코 병용요법의 유효성과 안전성을 평가하는 제3상, 무작위배정, 공개 시험으로 승인돼 주목받고 있다.
임상 4상시험에서는 노바티스의 ‘LEE011’가 유일하게 승인을 받았다. 해당 연구는 리보시클립(LEE011)을 투여 중인 환자에 대해 리보시클립 사용을 허용하기 위한 임상시험 후 약물 사용 전환 연구다.
한편 최근 임상3상에서 고전해왔던 SK바이오사이언스의 코로나19 백신은 최근 식품의약품안전처로부터 허가를 받았다.
식약처와 SK바이오사이언스측은 이번 허가에 대해 “대한민국도 코로나19 백신 개발국에 합류하게 됐다.”며 “코로나19 치료제(셀트리온 렉키로나주)와 코로나19 백신(SK바이오사이언스 스카이코비원 멀티주)를 모두 보유하게 됐다.”고 입을 모았다.
SK바이오사이언스가 밝힌 글로벌 임상 3상 결과에 따르면, 스카이코비원 2회 접종 시 바이러스 감염성을 중화해 예방효과를 유도할 수 있는 중화항체가 접종 전 대비 약 33배로 대조백신과 비교해 약 3배 높았다.
백신 접종 후 중화항체가 4배 이상 상승한 대상자를 의미하는 항체전환율 역시 98.06% 이상으로 확인됐으며 스카이코비원을 접종한 65세 이상 고령자에서도 중화항체가가 대조백신 대비 2.7배로 높았으며, 항체전환율은 95%를 넘었다.
관련기사
- 서울아산병원, 1분기 임상 8건 승인…주요 병원 중 최다 2025-04-02
- 1분기 주요 제약바이오사 임상시험 100건 승인 2025-04-01
- 4분기 임상 침체 속 희귀∙중증질환 3상 승인에 기대감↑ 2025-01-06
- 2분기 주요 제약바이오사 임상 130건 승인…MSD 강세 2024-07-01
- 1분기 주요 제약바이오사 임상 134건 승인…3상 이상이 34% 2024-04-02
- 4분기 ‘3상’ 임상승인 최다…출시 기대 약물은? 2024-01-02
- 3분기 임상승인 129건 중 과반이 1상에…어떤 약물 탄생될까 2023-10-04
- 2분기 임상시험, 1상 승인 최다…2상 최저 2023-07-01
- 1분기, 임상 승인건수 적지만 ‘3상 이상’ 우세 2023-04-04
- 4분기, 3상 임상승인 ‘최다’…2023년 출시 임박한 약은? 2023-01-02
- 갈수록 줄어드는 임상 승인, 3분기는 승인건수는 179건 2022-10-04
- 넥스트 국산 백신, 유바이오로직스가 탄생시킬까 2022-09-08
- ‘출시 기대’ 3상 승인된 코로나19 백신·치료제 총 4건 2022-07-11
- 1분기 임상시험 총 288건…작년 대비 1상 증가 2022-04-04
- 임인년 맞아 출시를 기대할 만한 신약은? 2022-01-03
- 3분기 임상시험 총 312건 진행…1·2·3상 모두 증가 2021-10-02
- 2분기 임상 총 286건…1상 늘고 2·3상 감소 2021-07-02
- 제약바이오사 2분기 임상시험, 진행상황은? 2020-07-20
- 서울대병원, 세계적 임상센터의 중심에 서다! 2010-10-12
- 국가임상시험사업단-애보트 MOU 협약 2010-10-08
- 정신질환자 임상시험 중 돌연 자살 '의혹 제기' 2010-10-04
- FDA, 임상시험 중 부작용 즉각 보고규정 마련 2010-10-02
- 서울대병원, 차세대 스텐트 임상시험 대규모 진행 2010-07-19
- 국내 임상시험 “약진”, 다국가 임상시험보다 앞서 2009-11-13
- 국내사 ‘1상’-다국적사 ‘3상임상’ 가장 많아 2009-08-04
- 신풍제약 ‘록스펜주’ 등 임상시험 6건 승인 2008-12-13
- “임상시험 등 각종 시험관련 의견 보내주세요” 2008-07-30
- 응급시 임상시험용약 사용 완화-승인기간 단축 2008-06-19
- [인사]노원을지대학교병원, 제20대 김재훈 병원장 취임
- [인사]전남대병원 안영근 교수, 2026년 대한심장학회 회장 취임
- [동정]칠곡경북대병원 최병호 교수, 국민교육발전 유공으로 교육부장관 표창 수상
- [동정]중앙대병원, 암환자 자기관리 앱 CAMA+ 연구로 국내외 학술대회 연속 수상
- [인사]한림제약 임원 인사 (1/1)
- [인사]순천향대 부천병원 채원석 교수, ‘대한외래마취학회 신임 회장’ 취임
- [인사]한국 머크 라이프사이언스, 프로세스 솔루션 사업부 총괄 김영임 대표 선임
- [인사]나이벡 임원 승진
- [동정]경희대한방병원 침구과 이승훈 교수, 보건복지부 장관 표창
- [인사]삼성서울병원 정용기 교수, 제4대 의료메타버스학회 회장 취임
- [인사]노원을지대학교병원, 제20대 김재훈 병원장 취임
- [인사]전남대병원 안영근 교수, 2026년 대한심장학회 회장 취임
- [인사]한림제약 임원 인사 (1/1)
- [인사]순천향대 부천병원 채원석 교수, ‘대한외래마취학회 신임 회장’ 취임
- [인사]한국 머크 라이프사이언스, 프로세스 솔루션 사업부 총괄 김영임 대표 선임
- [인사]나이벡 임원 승진
- [인사]삼성서울병원 정용기 교수, 제4대 의료메타버스학회 회장 취임
- [인사]리가켐바이오, 머크 출신 한진환 박사 신약연구소장 영입 (1/5)
- [인사]대구가톨릭대학교의료원 김홍태 교수, 제19대 대한해부학회 이사장 취임
- [인사]유한양행 1월 임원 인사
- [동정]칠곡경북대병원 최병호 교수, 국민교육발전 유공으로 교육부장관 표창 수상
- [동정]중앙대병원, 암환자 자기관리 앱 CAMA+ 연구로 국내외 학술대회 연속 수상
- [동정]경희대한방병원 침구과 이승훈 교수, 보건복지부 장관 표창
- [동정]고대 안산병원 이주한 교수, 기후에너지환경 정책 유공 장관 표창 수상
- [동정]국민건강보험 일산병원 김희선 센터장, 응급의료 유공 보건복지부 장관상 수상
- [동정]고대 안암병원 김영훈 교수, 민간 통일운동 공로로 대통령 표창
- [동정]경상국립대학교병원, 국가핵심기반 재난관리평가 장관표창 수상
- [동정]고대 안암병원 최혁순 교수, 서울시의회의장 표창
- [동정]이대서울병원 이상현 교수, 아시아관절경학회 최우수 구연 발표상 수상
- [동정]전북대병원 소아청소년과 김진규교수, 보건복지부장관 표창













