3분기 임상승인 129건 중 과반이 1상에…어떤 약물 탄생될까
129건 중 1상이상 65건, 2상이상 22건, 3상 이상 42건 등 승인
- 노영희 기자 nyh2152@medifonews.com
- 등록 2023-10-04 05:40:11
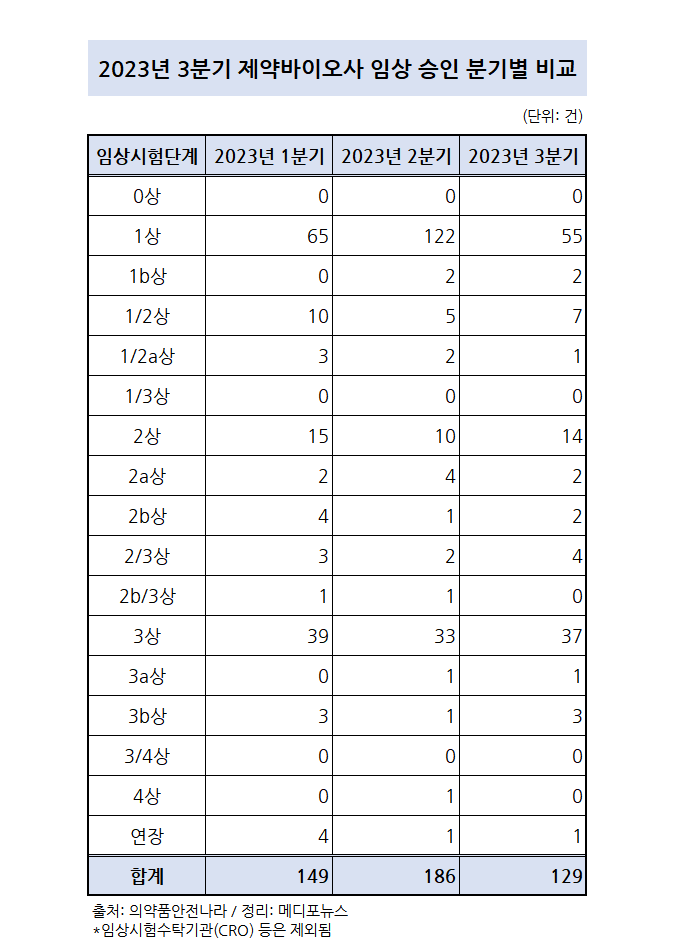
2023년 3분기 제약·바이오사가 승인받은 임상시험의 과반 이상이 1상이상 2상미만 단계에 있는 것으로 확인되면서 다양한 약물의 등장 가능성을 보이고 있다.
식품의약품안전처의 의약품 안전나라를 통해서 2023년 3분기 주요 제약바이오회사들의 임상시험 승인 건수가 총 129건으로 확인됐다. 이 중 129건 중 1상이상 2상미만이 65건, 2상이상 3상미만이 22건, 3상이상이 42건으로 주로 임상 진입 초기단계에서 높은 실적을 보였다.
◆1상이상 2상 미만, ‘대원제약’이 5건으로 최다
새 약물 개발을 위한 다양한 제약사들의 도전이 이뤄지고 있는 가운데, 이 단계에서는 대원제약이 5건으로 가장 많은 임상시험을 승인받았다. 세부적으로는 DW1122에 관한 임상 4건과 DW1021에 관한 임상 1건이었다.
‘DW1122’ 임상 중 2건은 건강한 성인 자원자를 대상으로 DW1122-T2와 각 단일제인 DW1122-R2와 DW1122-R3의 병용투여 시 식전 또는 식후에서의 안전성과 약동학적 특성을 비교 평가하기 위한 연구로 승인됐다.
또 건강한 성인 자원자를 대상으로 DW1122-T1과 각 단일제인 DW1122-R1과 DW1122-R2의 병용투여 시 식전 또는 식후에서의 안전성과 약동학적 특성을 비교 평가하기 위한 임상시험도 2건 승인됐다.
‘DW1021’ 임상시험은 건강한 성인자원자를 대상으로 DW1021-1과 DW1021-2 투여 시의 안전성과 약물상호작용 평가 및 DW1021과 DW1021-1/DW1021-3 투여 시의 안전성과 약동학적 특성을 비교 평가하기 위해 승인됐다.
다국적 제약사 중에서는 베이진코리아가 3건으로 가장 많았다.
‘BGB-11417’은 다발골수종에서 단독요법과 덱사메타손 및 카르필조밉과의 다양한 병용요법으로 연구가 진행된다.
‘BGB-16673’의 임상시험은 B세포 악성종양 환자를 대상으로 한 브루톤 타이로신 키나아제 표적 단백질 분해제의 제1상, 공개, 용량증량 및 용량확장 임상시험이다.
‘BGB-24714’의 연구는 고형암 환자를 대상으로 단일요법 및 병용요법으로 투여되는 두 번째 미토콘드리아 유래 카스파제 활성화제 유사체의 안전성, 내약성, 약동학, 약력학, 예비 항종양 활성을 연구하는 제1상 시험이다.
◆2상이상 3상미만, 다국적제약사가 지배적
본격적으로 다국적제약사가 우세한 2상이상 3상미만에서도 베이진코리아가 3건으로 가장 많은 임상을 승인받았다 이와 함께 GSK도 3건의 임상시험을 승인받았다.
GSK 제품 중 대표적으로 ‘RSVPreF3’ 연구는 2b상으로 승인됐으며 폐 및 신장 이식을 받은 성인(≥ 50세)에서 RSVPreF3 OA 임상시험용 백신의 면역반응 및 안전성을 평가하기 위해 1회 대 2회 용량을 비교하고 1회 용량을 투여 받은 건강한 성인 대조군(≥ 50세)과 비교될 전망이다.
‘GSK4057190’ 연구는 PD-L1 양성 재발성/전이성 두경부 편평세포암이 있는 시험대상자에서 마스터 임상시험계획서를 사용해 1차 치료로서 새로운 면역요법 병용을 평가하는 임상시험으로 승인됐다.
베이진코리아가 승인받은 3건의 2상 임상시험 중 첫 번째로 ‘BGB-A317’과 ‘LBL-007’의 임상시험은 절제 불가능한 국소 진행성 또는 전이성 식도 편평세포암종 환자의 1차 치료로서 티슬렐리주맙 및 화학요법에 병용투여한 LBL-007의 유효성 및 안전성 평가를 위해 승인됐다.
두 번째로 ‘BGB-A425’과 ‘BGB-A317’, ‘LBL-007’는 재발성 또는 전이성 두경부편평세포암 환자에서 1차 요법으로 임상시험용 제제와 병용한 티슬렐리주맙의 무작위배정, 제2상, 공개, 다중군 임상시험으로 승인받았다.
‘BGB-A317’과 ‘BGB-A445’, ‘LBL-007’ 연구는 마스터 임상시험 계획서에 따르면 이전에 치료를 받지 않은 국소 진행성, 절제 불가능, 또는 전이성 비소세포폐암 환자를 대상으로 한 화학요법을 병용하거나 병용하지 않는 티슬렐리주맙과 임상시험용 제제 병용요법의 제2상, 공개, 다중군 임상시험으로 승인됐다.
◆3상이상 연구, 아스트라제네카가 최다
3상이상에서도 다국적제약사의 임상 승인 비중이 압도적이었다. 이 중 한국아스트라제네카가 6건, 한국로슈가 5건으로 최다 승인이었다.
한국아스트라제네카의 제품 중 대표적으로 ‘MEDI5752‘는 백금 기반 동시화학방사선요법 이후 아직 질병이 진행하지 않은 고위험 국소 진행성 자궁경부암 여성 환자를 대상으로 Volrustomig를 평가하기 위해 임상을 승인받았다.
‘MEDI5752’의 또다른 임상 연구는 전이성 비소세포폐암 환자의 1차 선택 치료로서 Volrustomig+화학요법제의 유효성을 펨브롤리주맙+화학요법제와 비교해 결정하기 위해 승인받기도 했다.
한국로슈 중에서는 ‘GDC-9545’의 연구가 눈에 띈다. GDC-9545는 이전 보조 내분비요법에 내성이 있는 에스트로겐 수용체 양성, HER2 음성 진행성 유방암 환자에서 CDK4/6 억제제와 병용 시 풀베스트란트와 비교한 지레데스트란트의 유효성 및 안전성을 평가하고자 승인됐다.
‘RO7092284’는 치료 경험이 없는 국소 진행성 또는 전이성 간세포암종 환자에서 티라고루맙을 포함하거나 포함하지 않은 아테졸리주맙 + 베바시주맙을 평가한다.
관련기사
- 1분기 주요 제약바이오사 임상 134건 승인…3상 이상이 34% 2024-04-02
- 4분기 ‘3상’ 임상승인 최다…출시 기대 약물은? 2024-01-02
- 2분기 임상시험, 1상 승인 최다…2상 최저 2023-07-01
- 1분기, 임상 승인건수 적지만 ‘3상 이상’ 우세 2023-04-04
- 4분기, 3상 임상승인 ‘최다’…2023년 출시 임박한 약은? 2023-01-02
- 갈수록 줄어드는 임상 승인, 3분기는 승인건수는 179건 2022-10-04
- 넥스트 국산 백신, 유바이오로직스가 탄생시킬까 2022-09-08
- ‘출시 기대’ 3상 승인된 코로나19 백신·치료제 총 4건 2022-07-11
- 2분기 임상시험 승인 건수는 소폭 감소된 187건 2022-07-04
- 1분기 임상시험 총 288건…작년 대비 1상 증가 2022-04-04
- 임인년 맞아 출시를 기대할 만한 신약은? 2022-01-03
- 3분기 임상시험 총 312건 진행…1·2·3상 모두 증가 2021-10-02
- 2분기 임상 총 286건…1상 늘고 2·3상 감소 2021-07-02
- 제약바이오사 2분기 임상시험, 진행상황은? 2020-07-20
- 서울대병원, 세계적 임상센터의 중심에 서다! 2010-10-12
- 국가임상시험사업단-애보트 MOU 협약 2010-10-08
- 정신질환자 임상시험 중 돌연 자살 '의혹 제기' 2010-10-04
- FDA, 임상시험 중 부작용 즉각 보고규정 마련 2010-10-02
- 서울대병원, 차세대 스텐트 임상시험 대규모 진행 2010-07-19
- 국내 임상시험 “약진”, 다국가 임상시험보다 앞서 2009-11-13
- 국내사 ‘1상’-다국적사 ‘3상임상’ 가장 많아 2009-08-04
- 신풍제약 ‘록스펜주’ 등 임상시험 6건 승인 2008-12-13
- “임상시험 등 각종 시험관련 의견 보내주세요” 2008-07-30
- 응급시 임상시험용약 사용 완화-승인기간 단축 2008-06-19
- [인사]보건복지부 인사(4/26)
- [인사]제약협회, 홍보전문위원장에 최천옥 한림제약 상무 재추대
- [인사]건일제약, 오인수 신임 마케팅본부장 영입
- [인사]삼천당제약 2024년 정기승진인사 (4/23)
- [인사]오태윤 강북삼성병원 교수, 의료기관평가인증원 제6대 원장 임명
- [인사]한미사이언스, 노용갑 부회장 영입
- [인사]사노피 배경은 대표, 한국 및 호주/뉴질랜드 제약 총괄 다국가 리드 선임
- [인사]연세대학교의료원 인사
- [인사]서울성모병원 오득영 교수, 대한미용성형외과학회 이사장 취임
- [인사]고대 안암병원 함병주 교수, 대한생물정신의학회 이사장 취임
- [동정]전북대병원 이선영 교수팀, 국제학술지 ‘Cancers’ 에 논문 게재
- [동정]암젠, 아동·청소년 생명과학 교육 캠페인 서울시장 표창 수상
- [동정]칠곡경북대병원 성인 수두증 클리닉, 30억원 치매극복 기술개발 과제 수주
- [동정]갑상선 수술 관련 비디오 후두경 통한 기관삽관 유용성 입증
- [동정]한국머크 바이오파마, ‘일∙가정 양립 우수 기업’ 선정
- [동정]고대 구로병원 송준영 교수, 질병청·국립보건연구원 학술연구용역 과제 선정
- [동정]일동후디스 하이뮨, 브랜드파워 단백질보충제 부문 2년 연속 1위
- [동정]서울성모병원 정미향 교수, 국제학술지 유럽예방심장학회지 부편집장 임명
- [동정]한올바이오파마, 국가산업대상 ‘연구개발’ 부문 수상
- [동정]제주대병원 연구팀, 국제학술지에 심장재활 논문 게재















