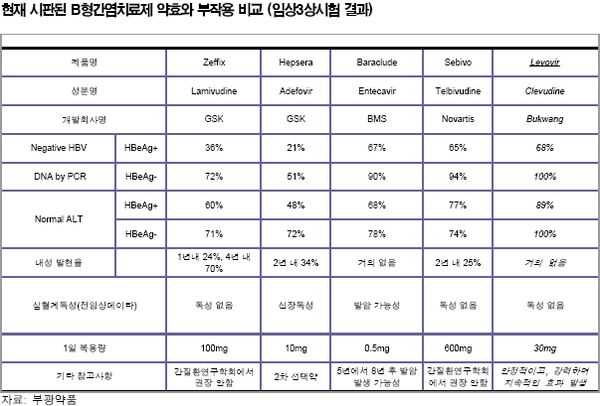
레보비르, 타 약제보다 바이러스 억제 효과 ‘탁월’
약물복용 중단 후 바이러스 억제지속 기간, 6개월 더 길어진 것으로 나타나
- 이영수 기자 juny@medifonews.com
- 등록 2007-09-12 12:30:00
최근 서울에서 열린 국제간학회에서 레보비르의 우수성이 입증돼 향후 레보비르의 B형 간염치료제 시장 지배력을 강화할 수 있는 계기가 마련됐다.
지난 8일 쉐라톤워커힐에서 열린 2007 년 서울국제간학회에서 레보비르의 국내에서 진행했던 임상 3상 시험에 대한 결과, 홍콩대학에서 1년 동안 진행했던 경쟁약물과의 임상시험 결과 발표가 있었다.
국내에서 진행했던 임상 3상에 대한 결과 발표에서는 레보비르가 기존 B형 간염치료제 시장을 주로 형성하고 있는 약물인 제픽스(GSK)와 헵세라(GSK&Gilead)보다약효는 탁월한 반면 부작용은 거의 없는 것으로 발표됐다.
또한 홍콩대학에서 실시한 최근 1년간 경쟁약물과의 임상시험 결과에서는 약물투여중단 후 바이러스 리바운딩 억제효과가 1년간 지속됐다는 점이 강조됐다.
이는 국내 임상결과에서 보다 약물복용 중단 후 바이러스 억제지속 기간이 6개월 더 길어진 것이다. 기존약물은 대부분 약물복용 중단 후 2개월 내에 바이러스가 리바운딩 되는 것으로 알려졌다.
이와 함께 현재 국내에서는 레보비르가 제픽스의 돌연변이 바이러스 감염환자를 대상으로 한 치료는 못하고 있는데 홍콩대학에서 진행하는 향후 48주 임상시험(환자90명대상)에서 이 부분을 보완할 것으로 보인다.
이는 홍콩대학에서 현재까지 환자 10명을 대상으로 시험한 결과, 제픽스의 돌연변이 바이러스 감염환자에 대한 치료가 이루어졌기 때문이다. 아울러 약효는 떨어지만 아직까지 전세계 B형 간염치료제로 쓰이는 Peg-Intron과의 병용투여연구도 향후 진행될 것으로 전망이다.
현재 레보비르는 한국을 제외한 아시아 10개국에 대한 판권을 일본의 Eisai사에 매각했는데 Eisai는 금년말에 임상 3상에 진입, 2010년에 상용화를 목표로 하고 있다. 아시아를 제외한 유럽, 미국, 기타 국가는 미국의 팜에셋사에 판권을 매각했는데 금년 4분기 중에 임상 3상에 진입할 전망이다.
관련기사
- 부광약품, ‘레보비르’ 부진 털고 상승세 전환하나 2010-04-13
- 부광 ‘레보비르’, 필리핀 발매 심포지움 성황 2010-03-15
- “레보비르 타격, 예상외 심각?”…매출 급감 2009-05-20
- 부광, ‘레보비르’ 오늘 공시후 즉각 “판매재개” 2009-05-13
- ‘레보비르’ 국산 B형간염약, “오늘 허용?” 2009-05-12
- “국산신약 ‘레보비르’, 판매재개 허용 확실” 2009-05-07
- 부광약품, 환자요구시 레보비르캡슐 무상공급 2009-04-25
- 부광, 레보비르 재판매 여부 중앙약심에 맡겨 2009-04-23
- 식약청, 레보비르 처방ㆍ투약시 각별한 주의 요구 2009-04-22
- 부광약품, “레보비르” 국내 판매 잠정 중단 2009-04-20
- 부광, 레보비르 해외 환산 적정가치 '4,700억원' 2008-10-11
- 부광, 레보비르의 매출호조 지속예상 2008-09-06
- 부광 '레보비르' 미FDA 승인에 한발 다가섰다 2008-08-14
- '클레부딘'과 '테노포비어' 복합임상 시험 돌입 2008-07-09
- 72주까지 클레부딘군 내성 발현율 ‘0%’ 2008-03-25
- 부광약품, ‘레보비르’ 덕에 ‘레벨업’ 2007-10-30
- B형 간염치료제 ‘레보비르’ 연매출 200억 달성 전망 2007-08-17
- 부광약품 레보비르, 연내 150억 달성 무난할 듯 2007-08-08
- [인사]윤을식 고려대의료원장, 사립대의료원협의회장 선출
- [동정]서울성모병원 강진형 교수, 35년 암 치료 여정 담은 에세이 출간
- [인사]아주대의료원 인사(3/1)
- [동정]애브비, 24회 GPTW ‘대한민국 일하기 좋은 100대 기업’ 8위에 선정
- [동정]바이엘 코리아, 2026 대한민국 일하기 좋은 100대 기업 26위 선정
- [동정]아스트라제네카, 성평등가족부 주관 ‘가족친화기업 인증’ 획득
- [동정]비원메디슨, ‘대한민국 일하기 좋은 100대 기업’ Top10 기업상 수상
- [동정]한국다케다제약, ‘대한민국·아시아 GPTW’로 동시 선정
- [동정]멀츠 에스테틱스 코리아, ‘대한민국 일하기 좋은 기업’ 2년 연속 1위 달성
- [동정]고대 안산병원, 경기국제의료협회장 표창
- [동정]서울성모병원 강진형 교수, 35년 암 치료 여정 담은 에세이 출간
- [동정]애브비, 24회 GPTW ‘대한민국 일하기 좋은 100대 기업’ 8위에 선정
- [동정]바이엘 코리아, 2026 대한민국 일하기 좋은 100대 기업 26위 선정
- [동정]아스트라제네카, 성평등가족부 주관 ‘가족친화기업 인증’ 획득
- [동정]비원메디슨, ‘대한민국 일하기 좋은 100대 기업’ Top10 기업상 수상
- [동정]한국다케다제약, ‘대한민국·아시아 GPTW’로 동시 선정
- [동정]멀츠 에스테틱스 코리아, ‘대한민국 일하기 좋은 기업’ 2년 연속 1위 달성
- [동정]고대 안산병원, 경기국제의료협회장 표창
- [동정]엔자임헬스, 건강친화기업으로 보건복지부 장관상 수상
- [동정]일동제약그룹 윤원영 회장, ‘대한민국 약업대상’ 수상













